マウス抗ヒト抗体(抗ヒトCD3抗体, OKT3)の発現と機能性評価
pHEK293 Ultra Expression Vector I/II(製品コード 3390/3392)
接着性HEK293T細胞
あらかじめ12ウェル細胞培養用プレートに培養しておいたHEK293T/17細胞に、TransIT-293 Transfection Reagent(製品コード MIR2704~2706)を使用して、キットのプロトコールに従ってIgG重鎖発現ベクターと軽鎖発現ベクターを同時にトランスフェクションを行った。各実験で使用したプラスミドを表1に示した。
浮遊性HEK293細胞
125 ml三角フラスコに培養した浮遊性HEK293細胞(Free Style 293-F cells、Thermo Fisher Scientific社製)に、キットのプロトコールに従ってIgG重鎖発現ベクターと軽鎖発現ベクターを同時にトランスフェクションを行った。各実験で使用したプラスミドを表1に示した。
表1
| 条件 | 細胞 | IgG重鎖発現ベクター | IgG軽鎖発現ベクター | pHEK293 Enhancer Vector | ||
| プラスミド 種類 |
プラスミド量 (μg) | プラスミド 種類 | プラスミド量 (μg) | プラスミド量 (μg) | ||
| 1 2 3 4 | 接着性 HEK293T細胞 | pBApo-CMV/HC Vector II/HC Vector II/HC Negative Control | 0.5 0.5 0.5 - | pBApo-CMV/LC Vector II/LC Vector II/LC Negative Control | 0.5 0.5 0.5 - | - 0.008 0.2 - |
| 5 6 7 8 | 浮遊性 HEK293細胞 | pBApo-CMV/HC Vector II/HC Vector II/HC Negative Control | 15 15 15 - | pBApo-CMV/LC Vector II/LC Vector II/LC Negative Control | 15 15 15 - | - 0.24 6 - |
pBApo-CMV:pBApo-CMV DNA(製品コード 3242)
Vector II:pHEK293 Ultra Expression Vector II(製品コード 3392)
【発現タンパク質の定量】
トランスフェクションから2、5、7、9日後に培養上清を回収し、Mouse IgG EIA KitによるMouse IgGの定量を行った。結果を図1に示した。その結果、pHEK293 Enhancer Vectorを使用することで5~7倍のMouse IgG発現量の向上が認められた。
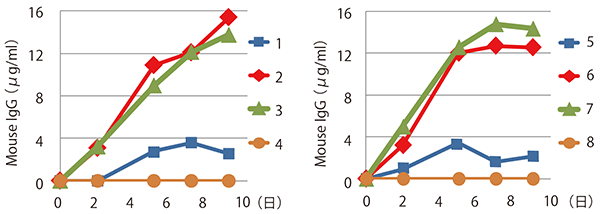
図1.マウスIgG(OKT3)の定量結果
【発現タンパク質精製と回収量測定、SDS-PAGE】
培養9日目の浮遊細胞において、pBApo-CMVでOKT3を発現させた培養液(表1条件5)と、pHEK293 Ultra Expression Vector IIおよびpHEK293 Enhancer Vectorで発現させた培養液(表1条件7)を回収した。遠心処理後(15,000 rpm, 10 min)、それぞれの上清をProtein Aカラムを用い抗体回収し、限外濾過による脱塩処理による精製を行った。対照として、Negative Control(表1条件8)と、OKT3を発現するハイブリドーマの培養上清(6日間培養)においても同様の操作を行った。精製したOKT3は、Mouse IgG EIA Kit(製品コード MK137)で定量を行った。その結果を表2に示す。

表2. マウスIgG(OKT3)の回収量測定結果
表1条件7の培養液から精製した総OKT3量は約269.6 μgとなり、条件5の約5倍であった。なお、同じ操作で精製したNegative Controlでは、OKT3の検出は認められなかった。表1条件7のOKT3精製量は、図1に示した発現結果を概ね反映していた。
精製した各OKT3は、還元剤(DTT)を含むSDSバッファー(還元)と、還元剤を含まないSDSバッファー(非還元)へそれぞれ溶解させ、SDS-PAGE、native-PAGEを行った。その結果、pHEK293 Ultra Expression Vector IIで発現させたOKT3は、他の方法で発現させたものと同じバンドパターンを示しており、同様の構造を有していることが示唆された(図2)。

図2. 精製物のSDS-PAGE、native-PAGE結果
サンプルアプライ量は約1.2 μg/lane
【機能性評価(1)発現タンパク質の結合活性】
精製した各OKT3抗体の結合活性を、抗原であるCD3陽性細胞に対する結合活性を指標として、フローサイトメーターを用いて評価した。結果を表3に示す。pHEK293 Ultra Expression Vector IIで生産したOKT3は、ハイブリドーマで生産したOKT3と比較して同等の結合活性を示すことが認められた。
表3. 精製OKT3の結合活性
【機能性評価(2)リンパ球培養試験】
OKT3はヒトTリンパ球の表面抗原であるCD3を認識するモノクローナル抗体であり、リンパ球培養においてTリンパ球を活性化し、増殖を促すことが知られている。pHEK293 Ultra Expression Vector IIで高発現させ上記の方法で精製したOKT3が、実際にリンパ球増殖効果を有しているかをリンパ球増殖培養試験で評価した。さらに、培養終了後リンパ球を用いて、表面抗原であるCD3、CD4、CD8の発現率を、フローサイトメーターを用いて解析した。
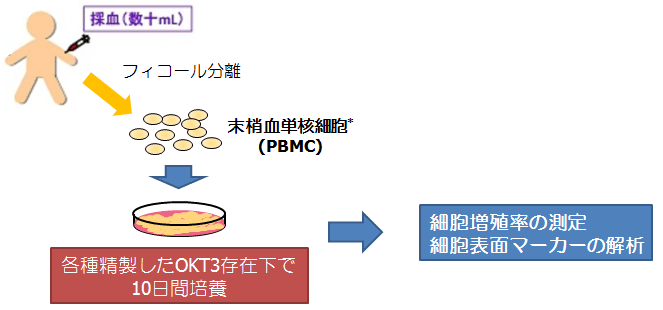
OKT3刺激によるリンパ球増殖培養試験は、インフォームドコンセントの得られた健常人ドナーより取得した末梢血単核細胞(PBMC)が1.0 X 106 cells/mlになるよう調整した培養液に、各種OKT3を30 ng/ml添加し、5% CO2, 37℃で培養した。培養4,7日目に、2.0 X 105 cells/mlになるよう、OKT3無添加の培地で希釈し、さらに培養を行った。細胞増殖の結果を図3で示す。培養4日目の写真より、各種OKT3を添加した全てのリンパ球はクラスター形成が確認でき、OKT3刺激によるリンパ球の活性化が認められた(培養7日目も同様の結果)。さらに拡大培養率の結果から、pHEK293 Ultra Expression Vector IIを用いて生産したOKT3は、他方法で生産したOKT3と同等のリンパ球増殖活性を示した。
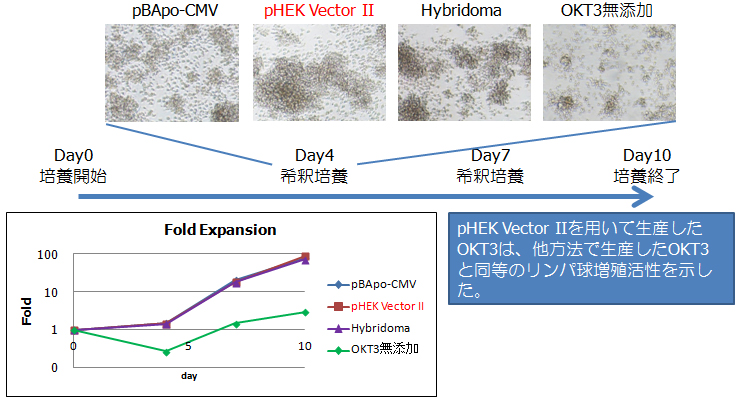
図3. 細胞増殖結果
次に、培養終了した10日目の細胞を回収し、CD3,CD4,CD8陽性率をフローサイトメーターで解析した。その結果、pHEK 293 Ultra Expression VectorIIを用いて生産したOKT3により増殖したリンパ球は、他OKT3と比較して、CD3, CD4, CD8の全てにおいて同等の表面抗原パターンを示した(図4)。
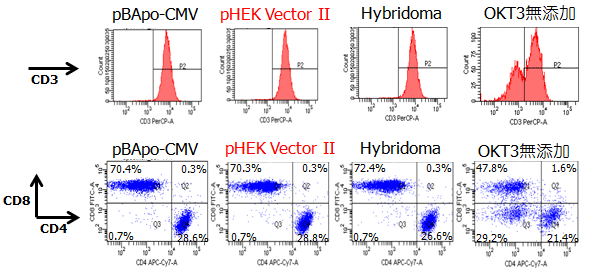
図4. CD3,CD4,CD8陽性率
以上の結果より、pHEK293 Ultra Expression Vector IIにより高生産されたOKT3は他方法で取得したOKT3と同様にリンパ球刺激能を保持していることが示された。
培養9日目の浮遊細胞において、pBApo-CMVでOKT3を発現させた培養液(表1条件5)と、pHEK293 Ultra Expression Vector IIおよびpHEK293 Enhancer Vectorで発現させた培養液(表1条件7)を回収した。遠心処理後(15,000 rpm, 10 min)、それぞれの上清をProtein Aカラムを用い抗体回収し、限外濾過による脱塩処理による精製を行った。対照として、Negative Control(表1条件8)と、OKT3を発現するハイブリドーマの培養上清(6日間培養)においても同様の操作を行った。精製したOKT3は、Mouse IgG EIA Kit(製品コード MK137)で定量を行った。その結果を表2に示す。

表2. マウスIgG(OKT3)の回収量測定結果
| pBApo-CMV | pHEK Vector II | OKT3 Hybridoma (参考,6日間培養) | |
|---|---|---|---|
| 培養上清量 | 27 ml | 27 ml | (7 ml) |
| 精製総OKT3量 | 55 μg | 269.6 μg | (117 μg) |
精製した各OKT3は、還元剤(DTT)を含むSDSバッファー(還元)と、還元剤を含まないSDSバッファー(非還元)へそれぞれ溶解させ、SDS-PAGE、native-PAGEを行った。その結果、pHEK293 Ultra Expression Vector IIで発現させたOKT3は、他の方法で発現させたものと同じバンドパターンを示しており、同様の構造を有していることが示唆された(図2)。

図2. 精製物のSDS-PAGE、native-PAGE結果
サンプルアプライ量は約1.2 μg/lane
【機能性評価(1)発現タンパク質の結合活性】
精製した各OKT3抗体の結合活性を、抗原であるCD3陽性細胞に対する結合活性を指標として、フローサイトメーターを用いて評価した。結果を表3に示す。pHEK293 Ultra Expression Vector IIで生産したOKT3は、ハイブリドーマで生産したOKT3と比較して同等の結合活性を示すことが認められた。
表3. 精製OKT3の結合活性
| pBApo-CMV | pHEK Vector II | OKT3 Hybridoma | |
|---|---|---|---|
| Hybridoma OKT3 に対する比活性 | 109.3 % | 119.0 % | 100.0% |
【機能性評価(2)リンパ球培養試験】
OKT3はヒトTリンパ球の表面抗原であるCD3を認識するモノクローナル抗体であり、リンパ球培養においてTリンパ球を活性化し、増殖を促すことが知られている。pHEK293 Ultra Expression Vector IIで高発現させ上記の方法で精製したOKT3が、実際にリンパ球増殖効果を有しているかをリンパ球増殖培養試験で評価した。さらに、培養終了後リンパ球を用いて、表面抗原であるCD3、CD4、CD8の発現率を、フローサイトメーターを用いて解析した。

OKT3刺激によるリンパ球増殖培養試験は、インフォームドコンセントの得られた健常人ドナーより取得した末梢血単核細胞(PBMC)が1.0 X 106 cells/mlになるよう調整した培養液に、各種OKT3を30 ng/ml添加し、5% CO2, 37℃で培養した。培養4,7日目に、2.0 X 105 cells/mlになるよう、OKT3無添加の培地で希釈し、さらに培養を行った。細胞増殖の結果を図3で示す。培養4日目の写真より、各種OKT3を添加した全てのリンパ球はクラスター形成が確認でき、OKT3刺激によるリンパ球の活性化が認められた(培養7日目も同様の結果)。さらに拡大培養率の結果から、pHEK293 Ultra Expression Vector IIを用いて生産したOKT3は、他方法で生産したOKT3と同等のリンパ球増殖活性を示した。

図3. 細胞増殖結果
次に、培養終了した10日目の細胞を回収し、CD3,CD4,CD8陽性率をフローサイトメーターで解析した。その結果、pHEK 293 Ultra Expression VectorIIを用いて生産したOKT3により増殖したリンパ球は、他OKT3と比較して、CD3, CD4, CD8の全てにおいて同等の表面抗原パターンを示した(図4)。

図4. CD3,CD4,CD8陽性率
以上の結果より、pHEK293 Ultra Expression Vector IIにより高生産されたOKT3は他方法で取得したOKT3と同様にリンパ球刺激能を保持していることが示された。
