2iによるGround State維持
製品説明
Cellartis 2i mES/iPSC Culture Mediumは、2種類の低分子阻害剤(CHIR99021, PD0325901=‘2i’)存在下でマウスES細胞株、iPS細胞株を作製するために調製された化学的成分既知の無血清培地である。CHIR99021、PD0325901はそれぞれ、GSK3βまたはERK/MEKからの分化誘導シグナルを抑制する効果を持ち、細胞の生存を促進する。マウスのpartial iPS細胞やpre‐iPS細胞を完全な多能性iPS細胞に変換するためにLIFを添加することも可能である。(参考文献1, 2)
naïveなground stateマウス多能性幹細胞の長期間の維持は、Cellartis 2i mES/iPSC Culture Mediumだけで可能である。
近年、2i阻害剤は生殖系列への分化可能なES細胞を得ることが困難であったマウス種からの誘導や(参考文献3)、ヒト及び家畜iPS細胞を作製する目的にも使用されるようになってきた。(参考文献4, 5 )
naïveなground stateマウス多能性幹細胞の長期間の維持は、Cellartis 2i mES/iPSC Culture Mediumだけで可能である。
近年、2i阻害剤は生殖系列への分化可能なES細胞を得ることが困難であったマウス種からの誘導や(参考文献3)、ヒト及び家畜iPS細胞を作製する目的にも使用されるようになってきた。(参考文献4, 5 )
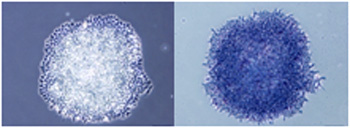 | 【未分化状態の確認】 (左) Cellartis 2i mES/iPSC Culture Mediumで培養したマウス ES細胞E14Tg2A株 (右) アルカリホスファターゼ染色 |
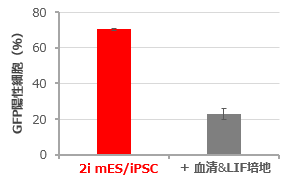 |
【 Cellartis 2i mES/iPSC Culture MediumによるマウスES細胞のGround Stateの高効率維持 】 Ground State状態にあるマウスES細胞(naive型mES)のマーカー遺伝子Rex1のプロモーター下流に蛍光タンパク(GFP)遺伝子を挿入したmES細胞株(Rex1GFPd2レポータ株※)を、Cellartis 2i mES/iPSC Culture Medium (LIF添加なし)と血清培地(10%FBS+LIF)を用いて3継代の間培養し、GFP陽性細胞(Ground State状態にあるmES細胞)の割合を評価した。 その結果、Cellartis 2i mES_iPSC Culture Mediumを用いた場合に70%を超えるGFP陽性細胞が検出され、高効率なGround state維持が確認された。 ※参考文献:Nat. Cell Biol. (2011) 13, 838-845. |
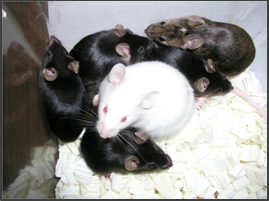 |
【 Cellartis 2i mES/iPSC Culture Mediumで培養したES細胞による高いキメラマウス作製率 】 フィーダーフリー条件下、 Cellartis 2i mES/iPSC Culture Mediumで約1週間培養したマウスES細胞を胚盤胞にインジェクションし、生まれてくるマウス個体の毛色にてキメラマウス作製率を評価した。 その結果、全身が100%黒い毛色の個体(マウスES細胞由来/写真中の白い毛色マウスは胚盤胞移植に用いた仮親マウス)を作製することができ、高いキメラ作製効率が得られることが確認された。 ※本データは、新潟大学脳研究所 崎村建司先生、 阿部学先生よりご提供いただきました。 |
内容
- Cellartis mES/iPSC Culture Basal Medium 200 ml
- Cellartis 2i mES/iPSC Supplement(DMSO含有)200 μl
保存
Cellartis mES/iPSC Culture Basal Medium:-20℃
Cellartis 2i mES/iPSC Supplement(DMSO含有):-80℃
(融解後は4℃で保存し、2週間以内に使用する)
必ず遮光して保存すること。
Cellartis 2i mES/iPSC Supplement(DMSO含有):-80℃
(融解後は4℃で保存し、2週間以内に使用する)
必ず遮光して保存すること。
培地の調製方法
- Cellartis mES/iPSC Culture Basal Mediumを遮光し、37℃ウォーターバスもしくは4℃保冷庫で融解する。
37℃ウォーターバスでの融解は、暖め過ぎないよう注意する。4℃保冷庫での融解は、沈殿が完全になくなるまで融解する。 - Cellartis 2i mES/iPSC Supplementを遮光し、室温で融解後(30分以内)スピンダウンした後、融解したCellartis mES/iPSC Culture Basal Mediumに無菌的に全量添加し、均一になるまで混合する。フィルター滅菌は避ける。
培養容器のコーティング処理の方法
培養容器のコーティング処理は、1または2のどちらかを選択して実施してください。
※1、2ともに培養器の培養面が完全に浸る液量を加えてください。
※細胞を播種する直前にコーティング剤を除去してください。
※ポリ-L-オルニチン溶液は水溶液が市販されています。
- 0.1% ゼラチン(Type A)溶液(PBS(-/-)に溶解)を培養容器に加えて室温もしくは37℃で30分間以上静置し、培養面をコーティングする。
- 0.01% ポリ-L-オルニチン溶液を培養容器に加えて、37℃で30分間以上静置した後、ポリ-L-オルニチン溶液を除き、PBS(-/-)で2回洗浄する。
その後、10 μg/ml ラミニン溶液(PBS(-/-)に溶解)を加えて、37℃で3時間以上静置して、培養面をコーティングする。
※1、2ともに培養器の培養面が完全に浸る液量を加えてください。
※細胞を播種する直前にコーティング剤を除去してください。
※ポリ-L-オルニチン溶液は水溶液が市販されています。
本製品以外に必要な試薬
・マウスES細胞、iPS細胞の場合
0.1% ゼラチン(Type A)/PBS(-/-)でコートした培養容器、あるいは、0.01% ポリ-L-オルニチン溶液でコーティング後、10 μg/ml ラミニン/PBS(-/-)でコートした培養容器を使用
・ヒトiPS細胞の場合は下記の文献参照
Wang W, et al. (2011) reference for more detailed reagent and culture requirements to generate and propagate ‘naïve’ human iPS cells
0.1% ゼラチン(Type A)/PBS(-/-)でコートした培養容器、あるいは、0.01% ポリ-L-オルニチン溶液でコーティング後、10 μg/ml ラミニン/PBS(-/-)でコートした培養容器を使用
・ヒトiPS細胞の場合は下記の文献参照
Wang W, et al. (2011) reference for more detailed reagent and culture requirements to generate and propagate ‘naïve’ human iPS cells
参考文献
- Promotion of Reprogramming to Ground State Pluripotency by Signal Inhibition.
Silva J, et al. (2008) PLoS Biol. 6: e253, - Nanog is the Gateway to the Pluripotent Ground State.
Silva J, et al. (2009) Cell 138(4): 722-737. - Validated germline‐competent embryonic stem cell lines from non‐obese diabetic mice.
Nichols J, et al. (2009) Nat. Med. 15: 814-818, - Rapid and efficient reprogramming of somatic cells to induced pluripotent stem cells by retinoic acid receptor gamma and liver receptor homolog.
Wang W, et al. (2011) PNAS (USA). 108(45): 18283-18288. - Reviewed in: Malaver‐Ortega LF, et al. Theriogenology. 78(8):1749
関連のオンラインガイド、資料はこちら
この製品を見た人は、
こんな製品も見ています
-
Cellartis® 3i mES/iPSC Culture Medium
3iによるGround State維持
-

Cellartis® human iPS cell line
分化誘導能確認済みのドナーの異なる株を複数ラインナップ
-

神経幹細胞維持/神経分化培地 RHB-A®
マウス・ヒト神経幹細胞の維持や神経分化に
-

Cellartis® 幹細胞用培地の使用文献紹介
-

Cellartis® DEF-CS™ 500 Culture System
簡便に高未分化維持!iPS細胞のゲノム編集にも最適な培養システム
-
神経分化培地 NDiff® 227(論文報告名:N2B27)
マウスES細胞の神経分化やヒトiPS/ES細胞のGraoud State維持に
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。