レンチウイルスベクター【CSII-CMV-MCS-IRES2-Venus】と【Lentiviral High Titer Packaging Mix】によるウイルス調製実験
方法
実験1.レンチウイルスベクターの感染能の比較
<レンチウイルスベクターの調製>HEK293T細胞(コラーゲンコートした60 mm dishで培養)に、Venus発現レンチウイルスベクタープラスミドとパッケージングプラスミドをコトランスフェクトした。
Venus発現レンチウイルスベクタープラスミドは、CSII-CMV-MCS-IRES2-Venus(RIKEN BRC DNA BANKより入手、Cat. RDB04383)を使用した。
パッケージングプラスミドは、Lentiviral High Titer Packaging Mix(製品コード 6194)を使用し、比較対照として普段使用しているパッケージングプラスミドを用いた。
また、トランスフェクションには、A社の試薬を使用した。
コトランスフェクションは、以下の量比で各試薬(1)~(4)を混合し、室温で5分静置後に行った。
なお、DNA総量は12.5 μgに合わせた。また,条件②の各ベクターの割合は、RIKENのプロトコール従って使用した(Lenti:Rev:HIVgp=17:10:10)。
| 条件① | 条件② | ||
|---|---|---|---|
| (1) | Opti-MEM | 750 μl | 750 μl |
| (2) | CSII-CMV-MCS-IRES2-Venus | 32.2 μl | 32.2 μl |
| (3) | Lentiviral High Titer Packaging Mix | 16.1μl | ― |
| or pCMV-VSVG-RSV-Rev + pCAG-HIVgp | ― | 11.27 μl+4.025 μl | |
| (4) | トランスフェクション試薬 | 40 μl | 40 μl |
<標的細胞への感染>
HEK293T細胞(コラーゲンコートした60 mm dishで培養)に、上記の培養上清5 ml、ポリブレン終濃度10 μg/mlで感染させ、翌日に蛍光顕微鏡を用いてVenusの蛍光を観察した。
実験2.細胞播種密度による感染への影響の検討
条件①で調製したウイルス感染時の細胞密度について、低密度・高密度で比較を行った。結果
実験1.レンチウイルスベクターの感染能の比較
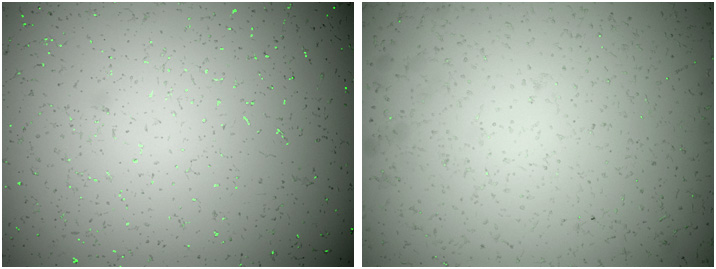
図1. トランスフェクション翌日のプラスミド導入効率の比較
条件①(左)、条件②(右)
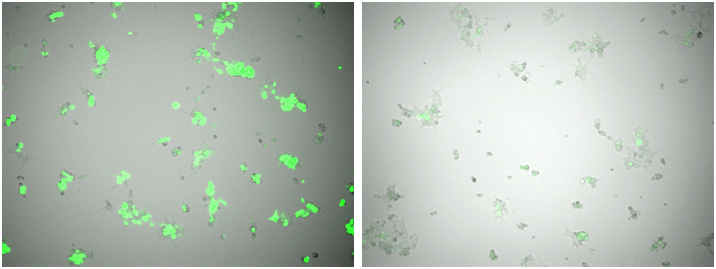
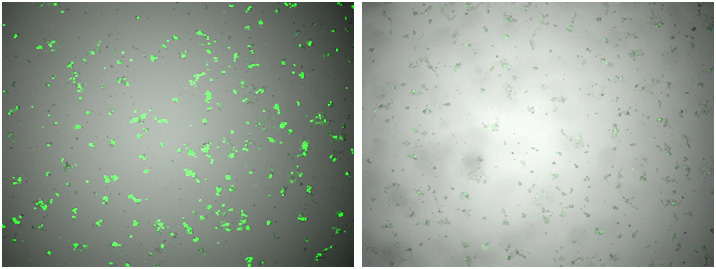
図2. ウイルス回収前の細胞の比較
条件①(左)、条件②(右)
(上段)高倍率、(下段)低倍率
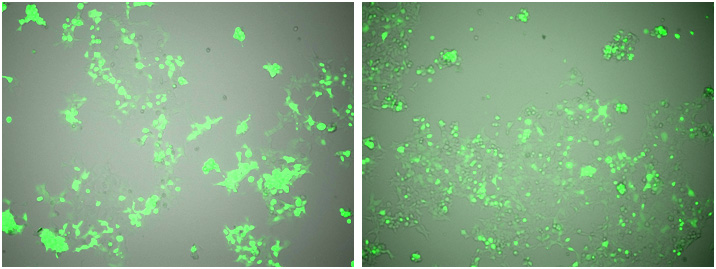
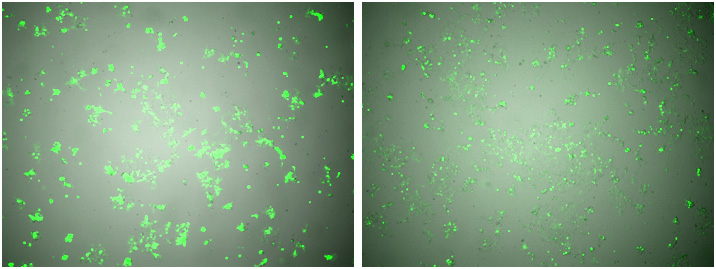
図3.ウイルス感染後の細胞の状態
条件①(左)、条件②(右)
(上段)高倍率、(下段)低倍率
標的plasmidの濃度は同一であり、トランスフェクション試薬の条件も同一であるが、条件①の蛍光強度が強く導入効率が良かった。
実験2.細胞播種密度による感染への影響の検討
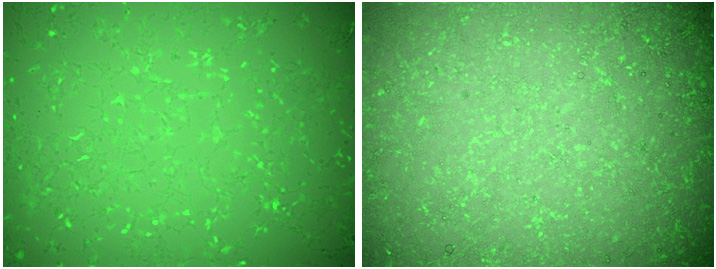
図4.ウイルス感染後の細胞の状態
低密度(左)、高密度(右)
ウイルス感染後、大きな差は認められなかった。
安定発現株を作成する際は、より多くの細胞を取得するために高密度で播種しても問題はなさそうであった。
※掲載写真は、露光時間などを全て同条件で撮影した蛍光写真と明視野写真をmerge
データご提供:O大学医学系研究科 K様
