In situ Apoptosis Detection Kitを用いた多重染色像
(千葉大学理学部生物学教室 遠藤 剛 先生のご好意により掲載)12)
蛍光三重染色によるアポトーシス観察の手順
<細胞培養>
↓ 増殖培地中で培養したマウスC2筋芽細胞をカバーガラス(18×18 mm)上にまく
↓ 分化培地に交換し、24~96時間培養する
<固 定>
↓10% ホルマリン(3.7% ホルムアルデヒド) in PBS、室温で15分
↓洗浄 PBS×3回
※この状態で4℃で保存可能
<浸透化>
↓0.2% Triton X-100 in PBS、室温で5分(またはPermeabilization Buffer、氷上で2~5分)
↓洗浄 PBS×3回
<一次抗体反応>
↓モノクローナル抗体MF20、室温で50分
↓洗浄 PBS × 4回
<FITC-dUTP標識 + 二次抗体反応>
↓Labeling Safe Buffer 50 μl + TdT 5 μl + Rhodamine-anti-mouse IgG、37℃で60分
<Hoechst 33258染色>
↓1 μg/ml Hoechst 33258、室温で1分
↓洗浄 PBS×4回
<包 埋>
↓1 mg/ml p-フェニレンジアミンを含む20% グリセロール in PBS
↓カバーグラスの周囲をマニキュアで封ずる
<蛍光顕微鏡による観察>
図 蛍光三重染色によるアポトーシスと分化細胞の検出
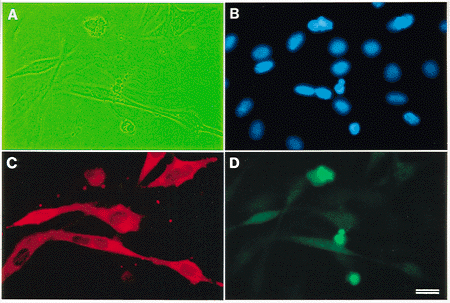
(A)位相差像。アポトーシス細胞に焦点を合わせてあるため、生細胞はあまり明瞭ではない。
(B)Hoechst 33258による核DNAの染色。
(C)MF20抗体によるミオシン重鎖発現細胞(分化細胞)の検出。
(D)FITC-dUTP標識によるアポトーシス細胞核の検出。
スケールバー: 20 μm
<細胞培養>
↓ 増殖培地中で培養したマウスC2筋芽細胞をカバーガラス(18×18 mm)上にまく
↓ 分化培地に交換し、24~96時間培養する
<固 定>
↓10% ホルマリン(3.7% ホルムアルデヒド) in PBS、室温で15分
↓洗浄 PBS×3回
※この状態で4℃で保存可能
<浸透化>
↓0.2% Triton X-100 in PBS、室温で5分(またはPermeabilization Buffer、氷上で2~5分)
↓洗浄 PBS×3回
<一次抗体反応>
↓モノクローナル抗体MF20、室温で50分
↓洗浄 PBS × 4回
<FITC-dUTP標識 + 二次抗体反応>
↓Labeling Safe Buffer 50 μl + TdT 5 μl + Rhodamine-anti-mouse IgG、37℃で60分
<Hoechst 33258染色>
↓1 μg/ml Hoechst 33258、室温で1分
↓洗浄 PBS×4回
<包 埋>
↓1 mg/ml p-フェニレンジアミンを含む20% グリセロール in PBS
↓カバーグラスの周囲をマニキュアで封ずる
<蛍光顕微鏡による観察>
図 蛍光三重染色によるアポトーシスと分化細胞の検出

(A)位相差像。アポトーシス細胞に焦点を合わせてあるため、生細胞はあまり明瞭ではない。
(B)Hoechst 33258による核DNAの染色。
(C)MF20抗体によるミオシン重鎖発現細胞(分化細胞)の検出。
(D)FITC-dUTP標識によるアポトーシス細胞核の検出。
スケールバー: 20 μm
