RetroNectinを用いた造血系細胞への遺伝子導入
―(1)骨髄由来c-kit陽性細胞への遺伝子導入(in vitroのアッセイ)
まず、RetroNectinをコートした培養器上で、レトロウイルスベクターを用いた造血幹細胞への遺伝子導入を以下のようにして行った。C57BL/6マウスの骨髄より採取した骨髄細胞から、抗c-kit抗体を用いてフローサイトメーターでソーティングすることによって、c-kit陽性細胞を単離した。得られたc-kit陽性細胞をSCF(stem cell factor)およびIL-6を含む培地で培養した後、レトロウイルスによる遺伝子導入に供した。あらかじめRetroNectinをコーティングしたプラスチックディッシュに上述の細胞とウイルス液を添加してインキュベートした後、HPP-CFCアッセイに供した。なお、本実験では、Neor遺伝子をマーカー遺伝子として用い、G418耐性コロニーの数を指標として遺伝子導入効率を求めた。その結果、図2に示すように遺伝子導入効率を大幅に上昇させることができた。
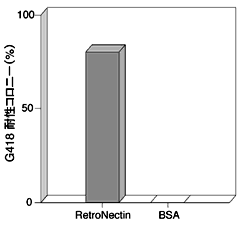
図2 RetroNectinを用いた骨髄由来c-kit陽性細胞への遺伝子導入(in vitroのアッセイ)
―(2)骨髄由来c-kit陽性細胞への遺伝子導入(in vivoのアッセイ)
次に、ヒトADA遺伝子を本法にて導入した細胞をマウスに移植し、次のようにして経過を観察した。ヒトADA遺伝子を導入したc-kit陽性細胞を、致死量の放射線を照射したC3H/HeJマウスに移植した。6ヶ月後、末梢血を採取し、酢酸セルロース膜を用いた電気泳動を行って、活性染色によりヒトADAの発現を分析した。なお、c-kit陽性細胞は、(1)と同様の方法でC3H/HeJマウスより単離した。
この結果、RetroNectinをコートした培養器上で遺伝子導入を行ったものでは、ウイルス産生細胞との共培養法で遺伝子導入を行ったものと同様、遺伝子産物のヒトADAが確認された*。このことは、移植したADA遺伝子導入細胞が移植したマウスで定着し、長期間にわたりADAを発現していること、つまり、造血幹細胞へ遺伝子が導入されたことを示している。
(*ADAの活性染色のデータについては、参考文献 2)中の図3参照)
―(3)骨髄由来CD34陽性細胞への遺伝子導入
健常人骨髄(BM)より採取した骨髄液からHisto Paqueを用いた密度勾配遠心により単核球に富んだ画分を分離し、次にこの画分をCD34陽性細胞分離用のマグネットビーズのカラム(MACS separation column)にかけ、CD34陽性細胞を単離した。得られたCD34陽性細胞をSCFおよびIL-6を含む培地で培養した後、レトロウイルスによる遺伝子導入に供した。あらかじめRetroNectinをコーティングしたプラスチックディッシュに、上述の細胞とレトロウイルス液を添加し、インキュベートした。ウイルスを感染させたCD34陽性細胞をSCF、IL-3、およびEPO(erythropoietin)を含むメチルセルロース培地中で培養し、分化の様子を観察した。なお、本実験では、Neor遺伝子をマーカー遺伝子として用い、G418耐性コロニーの数を指標として遺伝子導入効率を求めた。臍帯血(CB)由来のCD34陽性細胞についても同様の方法で遺伝子導入を行った。図4に示すように、臍帯血より分離したCD34陽性細胞を用いた場合でも骨髄由来のCD34陽性細胞の場合と同様に高い遺伝子導入効率を得ることができた。
このように、RetroNectinを用いた造血幹細胞への遺伝子導入法は、コーティングした培養器上でウイルスの感染を行うだけで高い遺伝子導入効率を得ることができ、ウイルス産生細胞と共培養する方法に比べてきわめて簡便な方法であることが示された。
レトロウイルスを介した遺伝子導入法では、ウイルスを宿主細胞に感染させる際に、高い導入効率を得るためにポリブレンが汎用されているが、このポリブレンの細胞に対する毒性が問題とされることがある。RetroNectinを使用した遺伝子導入法では、(2)の場合のように、ポリブレンを添加する必要はなく、遺伝子を導入したc-kit陽性細胞を移植したマウスにおいて導入遺伝子の発現が観察できる。
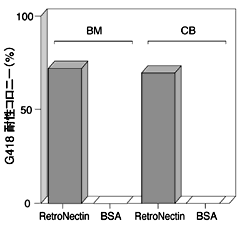
図4 RetroNectinを用いた骨髄由来CD34陽性細胞への遺伝子導入
まず、RetroNectinをコートした培養器上で、レトロウイルスベクターを用いた造血幹細胞への遺伝子導入を以下のようにして行った。C57BL/6マウスの骨髄より採取した骨髄細胞から、抗c-kit抗体を用いてフローサイトメーターでソーティングすることによって、c-kit陽性細胞を単離した。得られたc-kit陽性細胞をSCF(stem cell factor)およびIL-6を含む培地で培養した後、レトロウイルスによる遺伝子導入に供した。あらかじめRetroNectinをコーティングしたプラスチックディッシュに上述の細胞とウイルス液を添加してインキュベートした後、HPP-CFCアッセイに供した。なお、本実験では、Neor遺伝子をマーカー遺伝子として用い、G418耐性コロニーの数を指標として遺伝子導入効率を求めた。その結果、図2に示すように遺伝子導入効率を大幅に上昇させることができた。

図2 RetroNectinを用いた骨髄由来c-kit陽性細胞への遺伝子導入(in vitroのアッセイ)
―(2)骨髄由来c-kit陽性細胞への遺伝子導入(in vivoのアッセイ)
次に、ヒトADA遺伝子を本法にて導入した細胞をマウスに移植し、次のようにして経過を観察した。ヒトADA遺伝子を導入したc-kit陽性細胞を、致死量の放射線を照射したC3H/HeJマウスに移植した。6ヶ月後、末梢血を採取し、酢酸セルロース膜を用いた電気泳動を行って、活性染色によりヒトADAの発現を分析した。なお、c-kit陽性細胞は、(1)と同様の方法でC3H/HeJマウスより単離した。
この結果、RetroNectinをコートした培養器上で遺伝子導入を行ったものでは、ウイルス産生細胞との共培養法で遺伝子導入を行ったものと同様、遺伝子産物のヒトADAが確認された*。このことは、移植したADA遺伝子導入細胞が移植したマウスで定着し、長期間にわたりADAを発現していること、つまり、造血幹細胞へ遺伝子が導入されたことを示している。
(*ADAの活性染色のデータについては、参考文献 2)中の図3参照)
―(3)骨髄由来CD34陽性細胞への遺伝子導入
健常人骨髄(BM)より採取した骨髄液からHisto Paqueを用いた密度勾配遠心により単核球に富んだ画分を分離し、次にこの画分をCD34陽性細胞分離用のマグネットビーズのカラム(MACS separation column)にかけ、CD34陽性細胞を単離した。得られたCD34陽性細胞をSCFおよびIL-6を含む培地で培養した後、レトロウイルスによる遺伝子導入に供した。あらかじめRetroNectinをコーティングしたプラスチックディッシュに、上述の細胞とレトロウイルス液を添加し、インキュベートした。ウイルスを感染させたCD34陽性細胞をSCF、IL-3、およびEPO(erythropoietin)を含むメチルセルロース培地中で培養し、分化の様子を観察した。なお、本実験では、Neor遺伝子をマーカー遺伝子として用い、G418耐性コロニーの数を指標として遺伝子導入効率を求めた。臍帯血(CB)由来のCD34陽性細胞についても同様の方法で遺伝子導入を行った。図4に示すように、臍帯血より分離したCD34陽性細胞を用いた場合でも骨髄由来のCD34陽性細胞の場合と同様に高い遺伝子導入効率を得ることができた。
このように、RetroNectinを用いた造血幹細胞への遺伝子導入法は、コーティングした培養器上でウイルスの感染を行うだけで高い遺伝子導入効率を得ることができ、ウイルス産生細胞と共培養する方法に比べてきわめて簡便な方法であることが示された。
レトロウイルスを介した遺伝子導入法では、ウイルスを宿主細胞に感染させる際に、高い導入効率を得るためにポリブレンが汎用されているが、このポリブレンの細胞に対する毒性が問題とされることがある。RetroNectinを使用した遺伝子導入法では、(2)の場合のように、ポリブレンを添加する必要はなく、遺伝子を導入したc-kit陽性細胞を移植したマウスにおいて導入遺伝子の発現が観察できる。

図4 RetroNectinを用いた骨髄由来CD34陽性細胞への遺伝子導入
