ストップコドン導入による一倍体酵母のADE1, ADE2遺伝子の機能破壊実験
pAUR135 DNA (製品コード 3604)
【ストップコドン導入用DNA断片の調製】
ベクターのクローニング部位の制限酵素配列を5'端に付加したプライマー(forward:Sma I;reverse:Sac I or EcoR I)を作製し、出芽酵母ゲノムDNAを鋳型として、ADE1およびADE2遺伝子の一部領域をPCR増幅した。
| ADE1 | : | 1ヵ所切断サイト SnaB Iを含む約850 bp | |
| ADE2 | : | 1ヵ所切断サイト Xba Iを含む約1.2 kbp |
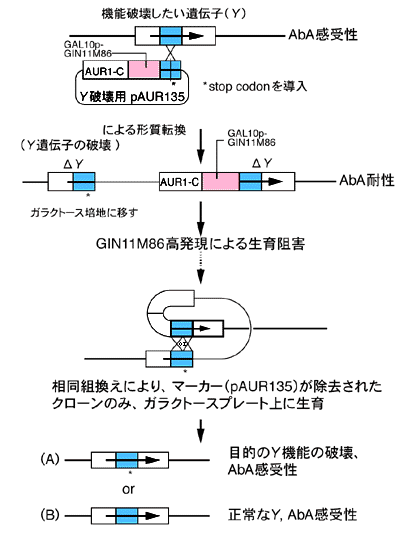
【遺伝子破壊】
ADE遺伝子破壊用プラスミドをそれぞれ、SnaB I, Xba Iで1ヵ所切断し直鎖状として形質転換を行った。宿主一倍体酵母としては、ガラクトース資化性の高いDKD-5D株と、やや弱い13-1A株を用いた。形質転換後、YPD液体培地で一晩培養し、0.5~0.8 μg/mlのオーレオバシジンAを含むYPDプレートに適宜塗布した。30℃で3日間培養後、それぞれから103クローン/μg DNA程度の形質転換体が得られた。32クローンずつピックアップし、すべてがアデニン要求性かつAbA耐性であることを確認した。
【マーカー除去株の選別】
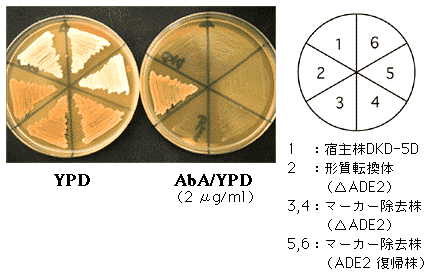
アデニン要求性(ADE遺伝子の機能破壊)を確認した形質転換体から8クローンずつを、爪楊枝を用いてYPGalactoseプレート上にストリークし、30℃で培養した。すべての形質転換体で明らかな生育阻害が起こり、GIN11M86の高発現が確認された。ガラクトース資化性の強いDKD-5D株を宿主とした形質転換体では、2~3日で、相同組換えによりマーカー除去体となったコロニーの生育が認められた。
YP Galactoseプレート上でのストリーク(30℃, 3日)
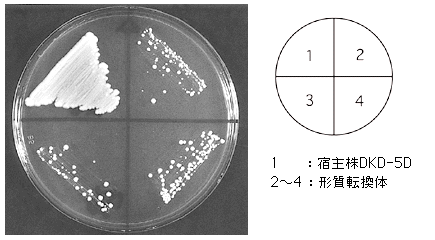
オーレオバシジンA感受性の比較(30℃, 2日)
マーカー除去の設定と結果
| 宿主 | 遺伝子破壊のターゲット | ||||
| 一倍体酵母株 | ADE1 | ADE2 | |||
| 相同組換え領域(bp)の比率 * | 415:440 | 740:475 | |||
| (A) (B) | (A) (B) | ||||
| ガラクトース生育コロニーの発生率 | DKD-5D | 1~6×10-6 | 1~6×10-6 | ||
| 13-1A | 1~6×10-6 | 1~6×10-6 | |||
| ガラクトース生育株の選択マーカー欠失率 | DKD-5D | >98% | >98.5% | ||
| 13-1A | >92% | >95% | |||
| ADE遺伝子破壊株:復帰株 | DKD-5D | 15:35 | 48:41 | ||
| 13-1A | 8:38 | 45:41 | |||
(A):(B)=(破壊体となる相同領域):(元に戻る相同領域)
さらに、各段階のクローンからゲノムDNAを精製し、PCRおよびサザンハイブリダイゼーションによってマーカー(pAUR135)が除去されていることを確認した。
サザンハイブリダイゼーションによるマーカー(pAUR135)除去の確認
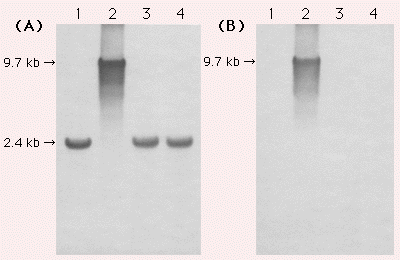
| 各株から取得したゲノムDNAを、形質転換に使用したプラスミドを切断しない制限酵素Aor51H IとNsp Vで切断しアガロースゲル電気泳動を行った。プローブには、遺伝子破壊に用いたADE2のDNA断片(A)とpUC18(B)を使用した。 | |||||||||
|
一方、ガラクトース資化性の弱い13-1A株を宿主とした実験では、4~5日目でYPGalactoseプレート上にコロニーの生育がみられ、DKD-5D同様、アデニン要求性のクローンと元に復帰したクローンとが混在していた。ただし、マーカー除去率はADE1で92%以上、ADE2で95%以上とやや低かった。このようにして得られたDKD-5D、13-1A株のADE1機能破壊株およびADE2機能破壊株は、宿主株と同レベルのオーレオバシジンA感受性を示し、pAUR135による再度の形質転換が可能である。
