Campylobacter (cdt gene) PCR Detection and Typing Kit
検出プロトコール
Campylobacter (cdt gene) PCR Detection and Typing Kit(製品コード RR134A)
A. 食品、便、土壌や水などの環境由来検体の調製例
- 増菌培養後、分離培養法を組み合わせて、菌を回収した後、PCRを行う場合
- (1)検体を培地等に直接懸濁する、もしくはストマッカー等を用いて等量揉み出し液を作製する。
- (2)得られた処理液を10倍量のボルトン培地もしくはプレストン培地に加え、37℃、24~48時間、微好気条件下(5% O2, 10% CO2, 85% N2)で増菌培養を行う。
- (3)増菌培養液 100 μlをスキロー寒天培地等の選択培地、もしくはフィルター法 [ 血液寒天上に滅菌用メンブレンフィルター(孔径 0.45 μm)を置き、その上に増菌培養液を広げる。30分間 室温で静置した後、フィルターを取り除き、培養する ] にて 37℃、48時間、微好気条件下(5% O2, 10% CO2, 85% N2)で分離培養を行う。
- (4)プレート(スキロー寒天培地など)上のコロニーから、滅菌済み白金耳などで微量の菌体をとり、TE buffer(10 mM Tris-HCl, 0.1 mM EDTA, pH8.0)に懸濁する。このときの菌濃度は濁度(600 nm)で約0.1を目安に調製する。
- (5)95℃で10分間、熱処理する。
- (6)15,000 rpm、10 分間遠心して得られた上清を熱抽出サンプルとする。
- 増菌培養液もしくは検体からPCRを行う場合
- (1)増菌培養液もしくは検体の懸濁液を軽く遠心(1,200 rpm, 5 分間) し、残渣を取り除いた後、15,000 rpm、10分間遠心する。
- (2)得られた沈殿に適量のTE bufferを加え、95℃で10分間遠心して得られた上清を熱処理サンプルとする。もしくはNucleoSpin Tissue(製品コード 740952.10)を用いてDNAを抽出し、PCRテンプレートとする。
B. PCR反応
反応液調製・反応条件
正しい検出結果を得るためにNegative control反応とPositive control反応を一緒に行ってください。
- 必要本数分(サンプル数 + Negative control + Positive control + α)の下記のマスターミックスを氷上にて調製する。
| 1反応分 |
| Premix Ex Taq HS | 25 μl |
| cdtB Primer Mix or cdtC Primer Mix | 5 μl |
| 滅菌精製水 | 15 μl |
| 45 μl |
- Positive control反応として各Positive controlを5 μl添加したものを準備する。Negative control以外の各チューブに調製した抽出サンプルを5 μl添加し、しっかりふたをする。
【PCR条件】
| 94℃ | 30 sec. | | 30~40 cycles |
| 55℃ | 30 sec. |
| 72℃ | 30 sec. |
● 反応は約2時間で終了する。反応後のサンプルは 4℃、または-20℃で保存可能である。
C. 判定
PCR反応による各増幅産物の大きさは、以下の通りです。
cdtB Primer MixによるPCR反応による各増幅産物の大きさ(
cdtB遺伝子)
| 菌種 | サンプル(各ゲノムDNA)由来増幅産物 | 各Positive Control由来増幅産物 |
|---|
| C. jejuni | 714 bp | 274 bp |
| C. fetus | 553 bp | 203 bp |
| C. coli | 413bp | 153 bp |
cdtC Primer MixによるPCR反応による各増幅産物の大きさ(cdtC 遺伝子)
| 菌種 | サンプル(各ゲノムDNA)由来増幅産物 | 各Positive Control由来増幅産物 |
|---|
| C. jejuni | 524 bp | 274 bp |
| C. fetus | 397 bp | 202 bp |
| C. coli | 313 bp | 154 bp |
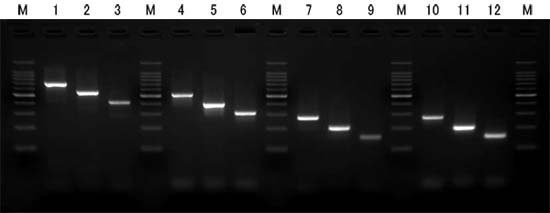
| レーン | 使用プライマー | 使用鋳型 | 鋳型使用量 | 増幅サイズ |
|---|
| 1 | cdtB Primer Mix | C. jejuniゲノムDNA | 5 pg | 714 bp |
| 2 | C. fetusゲノムDNA | 553 bp |
| 3 | C. coliゲノムDNA | 413 bp |
| 4 | cdtC Primer Mix | C. jejuniゲノムDNA | 524 bp |
| 5 | C. fetusゲノムDNA | 397 bp |
| 6 | C. coliゲノム DNA | 313 bp |
| 7 | cdtB Primer Mix | C. jejuni Positive Control | 5 μl | 274 bp |
| 8 | C. fetus Positive Control | 203 bp |
| 9 | C. coli Positive Control | 153 bp |
| 10 | cdtC Primer Mix | C. jejuni Positive Control | 274 bp |
| 11 | C. fetus Positive Control | 202 bp |
| 12 | C. coli Positive Control | 154 bp |
| M | 100 bp DNA ladder |
- Negative control反応において増幅産物が得られていないことを確認してください。もし上記サイズの増幅産物が得られている場合、コンタミネーションを起こしていると考えられます。反応液調製場所及び使用した機器を除染したうえですべてのサンプルで再度反応を行ってください。
- Positive control反応において、各 Positive Control由来増幅産物サイズの増幅産物が得られていることを確認してください。正しいサイズの増幅産物が得られなかった場合、何らかの理由で PCR 反応が進まなかったことが考えられます。理由としては、機器の不調、試薬調製の不備、試薬の劣化等が挙げられます。再度反応を行ってください。
- Negative control反応、Positive Control反応の結果が正しく得られた場合において、cdtBまたはcdtC遺伝子のどちらか一方でもサンプル(各ゲノムDNA)由来増幅産物が得られた場合、サイズに該当する菌種を検出したことになります。
- Negative control反応、Positive Control反応の結果が正しく得られた場合において、熱抽出サンプルを用いて反応した結果、該当サイズ増幅産物が得られなければ、陰性(検出限界以下)であると判定します。
注意:検出されるべき菌種が存在する検体から調製した熱抽出サンプルにPCR阻害物質が含まれている場合も該当サイズ増幅産物が得られないことがあり、陰性と判定をしてしまうことがあります(偽陰性判定)。このような判定結果を免れるため、陰性と判断された場合、熱抽出サンプルに3種類のうちのいずれかのPositive Control(5 μl)を加えてPCRを行い、Positive Control由来増幅産物サイズの増幅産物が得られることを確認してください。目的サイズの増幅産物が得られない場合、サンプルにPCR阻害物質が含まれていることが考えられます。その場合、再反応およびサンプルの再調製をお勧めします。
Campylobacter (cdt gene) PCR Detection and Typing Kit


