Applied Biosystems 7300 Real-Time PCR System、StepOnePlus™ Real-Time System(Thermo Fisher Scientific社)を用いる場合の反応プロトコール
- 下記に示すPCR反応液を調製する。
<1反応あたり>
試薬 使用量 使用量 最終濃度 Premix Ex Taq (Probe qPCR) (2×conc) 10 μl 25 μl 1× PCR Forward Primer (10 μM) 0.4 μl 1 μl 0.2 μM*1 PCR Reverse Primer (10 μM) 0.4 μl 1 μl 0.2 μM*1 プローブ 0.8 μl 2 μl *2 ROX Reference Dye(50×)*3 0.4 μl 1 μl 1× template 2 μl 4 μl *4 滅菌精製水 6 μl 16 μl Total 20 μl*5 50 μl*5
*1 最終プライマー濃度は0.2 μMで良い結果が得られる場合が多いが、反応性に問題があるときは0.1~1.0 μMの範囲で最適な濃度を検討すると良い。 *2 プローブ濃度は、使用するリアルタイムPCR装置の機種やプローブの蛍光標識物質により異なる。装置の取扱い説明書やプローブの添付データシートを参考に添加量を検討する。 *3 ROX Reference Dye(50×)は最終濃度1×で使用する。 *4 template溶液中に存在するターゲットのコピー数により異なる。段階希釈して適当な添加量を検討する。反応液20 μlあたりDNA template 100 ng以下を用いることが望ましい。また、RT-PCRでcDNA (RT反応液) をtemplateとして添加する場合は、PCR反応液量の10%以下になるようにする。 *5 各装置の推奨容量に従って調整する。
- 反応を開始する。
PCRは、下記のシャトルPCR標準プロトコールで行うことをお勧めする。まず、このプロトコールを試し、必要に応じてPCR反応条件を至適化してください。(「PCR反応条件について」を参照。)<7300 Real-Time PCR System>
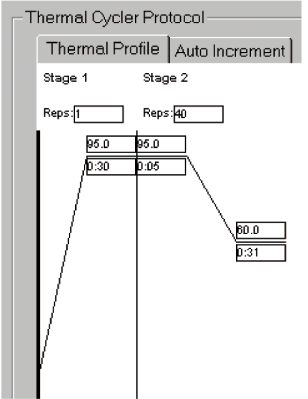
シャトルPCR標準プロトコール
Stage 1 :初期変性
Reps:1
95℃ 30秒
Stage 2 :PCR反応
Reps:40
95℃ 5秒
60℃ 31秒
<StepOnePlus Real-Time PCR System>
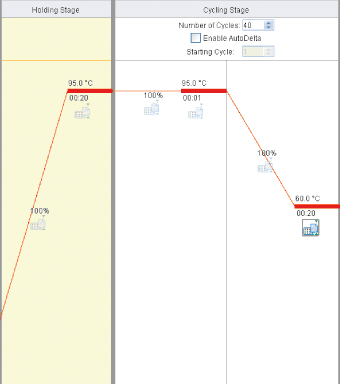
Fastプロトコール
Holding Stage
Reps : 1
95℃、20秒
Cycling Stage
Number of Cycles:40
95℃、1秒
60℃、20秒
- 反応終了後、解析を行う。
反応終了後、増幅曲線を確認し、定量を行う場合は検量線を作成する。
* 解析方法は、リアルタイムPCR装置の取扱説明書を参照してください。
<PCR反応条件について>
初期変性
| ステップ | 温度 | 時間 | 検出 | コメント |
| 初期変性 | 95℃ | 30秒 | OFF | 初期変性は通常95℃、30秒で十分である。環状プラスミドやゲノムDNAなど変性しにくい鋳型でもこの条件で良好に反応できることが多い。鋳型の状態によっては、95℃、1~2分程度に延長することが可能だが、時間が長すぎると酵素の失活をまねく怖れがあるので、2分以上の条件は推奨しない。 |
シャトルPCR
| ステップ | 温度 | 時間 | 検出 | コメント |
| 変性 | 95℃ | 3~5秒 | OFF | リアルタイムPCRの増幅サイズは一般的に300 bp以下なので、95℃で3~5秒程度でよい。 |
| アニーリング/伸長 | 56~64℃ | 20~30秒 (31秒)*7 | ON | まずは各々の標準プロトコールを試す。反応条件の至適化を行う場合には、56℃~64℃の範囲で検討する。反応性が悪い時は、このステップの時間を延ばすと改善する場合がある。 |
