LightCycler®を用いる場合の操作方法
TB Green™ Premix Ex Taq™ II (Tli RNaseH Plus)(製品コード RR820A/B)
- 下記に示すPCR反応液を調製する。
<1反応あたり>試薬 使用量 最終濃度 TB Green Premix Ex Taq II(2×) 10 μl 1× PCR Forward Primer(10 μM) 0.8 μl 0.4 μM *1 PCR Reverse Primer(10 μM) 0.8 μl 0.4 μM *1 template(<100 ng)*2 2 μl 滅菌精製水 6.4 μl total 20 μl *1 最終primer濃度は0.4 μMで良い結果が得られる場合が多いが、反応性に問題があるときは 0.2~1.0 μMの範囲で最適な濃度を検討すると良い。
*2 template溶液中に存在するターゲットのコピー数により異なる。 段階希釈して適当な添加量を検討する。DNA template 100 ng以下を用いることが望ましい。また、RT-PCRでcDNA(RT反応液)をtemplateとして 添加する場合は、添加量をPCR反応液容量の10%以下とする。
-
PCRキャピラリーを遠心機で軽く遠心後、LightCyclerにセットし、反応を開始する。
PCR反応は、下記のシャトルPCR標準プロトコールで行うことをお勧めします。
まずはこのプロトコールを試し、必要に応じてPCR条件を至適化してください。
Tm値が低めのプライマーなど、シャトルPCRでの反応が難しい場合には、3ステップPCRを行います。(PCR条件を至適化する場合は、「実験条件の選び方」をご参照ください。)
シャトルPCR標準プロトコール
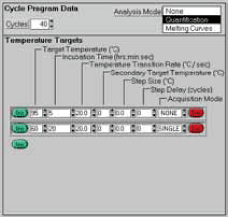 Stage 1:初期変性
Stage 1:初期変性
95℃、30秒 20℃/秒
1サイクル Stage 2:PCR反応
95℃、5秒 20℃/秒
60℃、20秒 20℃/秒
40サイクル Stage 3:融解曲線分析 95℃、0秒 20℃/秒
65℃、15秒 20℃/秒
95℃、0秒 0.1℃/秒※使用上の注意
本製品に使用しているTaKaRa Ex Taq HSはポリメラーゼ活性を抑制する抗Taq抗体を利用したホットスタートPCR用酵素です。 他社の化学修飾タイプのホットスタートPCR酵素で必要なPCR反応前の95℃(5~)15分の活性化ステップは行わないでください。 必要以上の熱処理を加えると酵素活性が低下し、増幅効率、定量精度に影響を及ぼす傾向があります。
PCR反応前に鋳型の初期変性を行う場合でも、通常95℃ 30秒で充分です。 -
反応終了後、増幅曲線と融解曲線を確認し、定量を行う場合は検量線を作成する。
解析方法は、リアルタイムPCR装置の取扱説明書を参照してください。
