純度の高い高分子ゲノムDNA精製プロトコール(液体窒素下ですりつぶす場合)
NucleoBond HMW DNA(製品コード 740160.20)
| 試薬の準備 | Buffer H1が沈殿していないことを確認する。 沈殿している場合は50℃で数分間温めて溶解させる。 | |
| 1. | サンプルの準備 |  植物の葉 1.5 gまでの植物の葉を液体窒素の存在下で、乳鉢などですりつぶし、 あらかじめ冷やした50 mlのチューブに入れる。 動物組織 300 mgまでの動物組織を細切れにしたのち、液体窒素の存在下で乳鉢などですりつぶし、 50 mlのチューブに入れる。 バクテリア、酵母 30 mgのバクテリアまたは酵母を液体窒素の存在下で、乳鉢などですりつぶし、 50 mlのチューブに入れる。 |
| 2. | 溶解Bufferの添加 |  Buffer H1 5 mlとLiquid Proteinase K 200 μlを加える。 Vortexで5秒間混合する。 |
| 3. | サンプルの溶解 |  時々混合しながら50℃で30分間インキュベートして溶解させる。 |
| 4. | RNAの分解 |  Liquid RNase A 100 μlを添加して、転倒混和を行う。 室温で5分間インキュベートする。 |
| 5. | カラムの平衡化 | 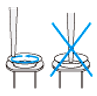 カラムフィルターを挿入したNucleoBond HMW ColumnをBuffer H2 12 mlで平衡化する。 |
| 6. | Bufferの添加 |  4の溶液にBuffer H2 10 mlを加えて転倒混和する。 |
| 7. | カラムへの結合 | 5のカラムに6の溶液を添加し、自然落下させてカラムを空にする。 |
| 8. | フィルターの共洗い |  Buffer H3 6 mlをカラムフィルターの縁から加え、自然落下で通す。 カラムが空になったら、カラムフィルターを取り除く。 |
| 9. | カラムの洗浄 |  Buffer H4 12 ml添加し、自然落下でカラムを空にする。 |
| 10. | 溶出 |  カラムの下に50 mlチューブをセットして、Buffer H5 5 mlをカラムに加え、DNAを溶出させる。 |
| 11. | 沈殿 |  イソプロパノール 3.5 mlを加えて、10回転倒混和を行う。 4,500×g以上室温で10分間遠心して、DNAを沈殿させる。 上清を注意深く除去する。  |
| 12. | 乾燥 |  70%エタノール2 mlを加え、4,500×g以上で室温5分間遠心した後、 注意深く上清を完全に取り除く。エタノールの液滴が見えなくなるまで、 室温で風乾する。(過剰な乾燥は避ける)  |
| 13. | DNAの溶解 | 150 μlのBuffer HEを加えて、ゆっくり揺らしながら溶解させる(完全に溶解させるためには 終夜程度の時間をかけることが必要)。以後の実験には広口のピペットチップを使用することが 望ましい。 |
<注意>
使用時には、詳細は必ず添付の英文説明書を確認すること。
