TRACP & ALP活性染色例 -ヒト骨髄由来単核細胞、ラット骨髄由来分化細胞ほか-
実験例
- 実施例:1
- 条件1~3の各種ウサギ培養骨髄細胞を以下の染色条件(1)~(3)で染色した。
- (1) 酒石酸耐性酸性ホスファターゼ(TRACP)およびアルカリ性ホスファターゼ(ALP)による二重染色
(2) 酒石酸耐性酸性ホスファターゼ染色
(3) アルカリ性ホスファターゼ染色
- 条件1
- 16週齢JWウサギ(雄)から採取した骨髄細胞をM-CSFおよび活性型ビタミンD3の存在下で培養し、6日目に酒石酸耐性酸性ホスファターゼ活性染色を行った(図1)。
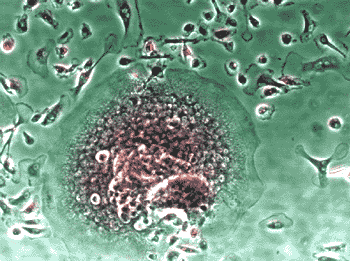
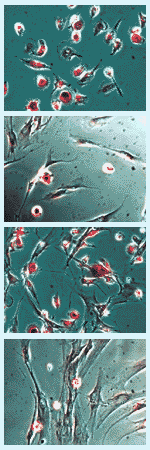
図1. ウサギ培養骨髄細胞の (2) 酒石酸耐性酸性ホスファターゼ活性染色
- 条件2
- 8週齢ウサギ骨髄細胞を24 wellプレート1枚で培養。培養開始後6日目に染色。位相差顕微鏡観察例(図2)。
図2. 各染色条件におけるウサギ培養骨髄細胞
- 条件3
- 上記と同一条件で、20 週齢ウサギ骨髄細胞を24 wellプレート1枚で培養。培養開始後6日目に染色(図3)。
図3. 各染色条件におけるウサギ培養骨髄細胞
- 実施例:2
-
24日齢SDラット(雌)から採取した骨髄細胞をM-CSFおよび活性型ビタミンD3の存在下で培養し、10日目にアルカリ性ホスファターゼ活性染色を行った(図4)。

図4. ラット培養骨髄細胞のアルカリ性ホスファターゼ活性染色
- 実施例:3
-
ヒト骨髄由来単核細胞(Human Bone Marrow Mononuclear Cells, Lonza社)を、種々の添加因子の存在下で培養し、分化細胞となった時期(移植後9日目)に、酒石酸耐性酸性ホスファターゼおよびアルカリ性ホスファターゼの活性染色をそれぞれ行った(図5)。
 図5. ヒト培養骨髄細胞の酒石酸耐性酸性ホスファターゼおよびアルカリ性ホスファターゼ活性染色
図5. ヒト培養骨髄細胞の酒石酸耐性酸性ホスファターゼおよびアルカリ性ホスファターゼ活性染色
- 実施例:4
-
ラット骨髄細胞をM-CSFおよび活性型ビタミンD3存在下で培養し、分化細胞とした。
12日目に活性二重染色を実施した(図6)。
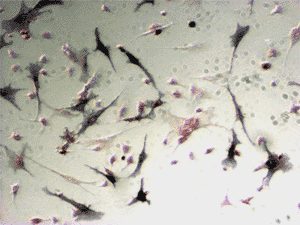
図6. TRACPとALPの活性二重染色
- 実施例:5
-
新生1日目マウスの凍結切片を用いて、TRACP酵素とALP酵素のそれぞれの活性染色を実施した。2枚の凍結スライド上にキットの細胞固定液を各250 μl滴下し、室温5分間の固定処理後、純水でよく洗浄し、臓器のまわりの余分な水分をペーパーでふきとった。1枚には酒石酸を加えたTRACP基質250 μlをスライド上に滴下し、他の1枚にはALP基質250 μlを滴下して、37℃インキュベータ-に静置した。45分後に基質液を純水で洗って除き、余分な水分をふきとって、そのまま検鏡した。スライドは薄切後、約6ヵ月間-80℃保存していたものであったが、酵素活性は、薄切当時に実施した活性染色とほとんど変わらない結果が得られた(図7)。
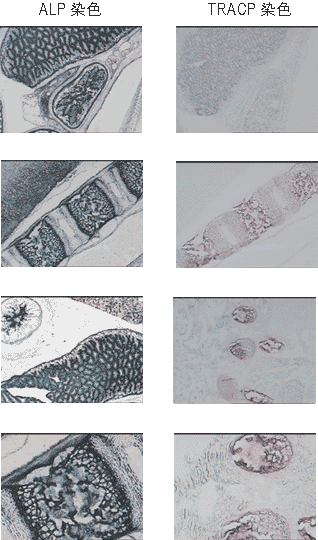
図7. 新生1日目マウス新鮮凍結切片の酵素活性染色


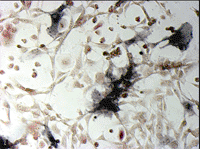
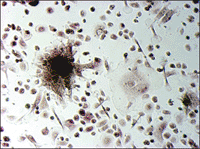

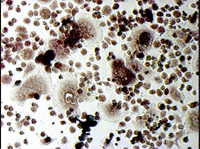
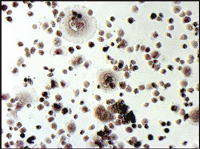


 図5. ヒト培養骨髄細胞の酒石酸耐性酸性ホスファターゼおよびアルカリ性ホスファターゼ活性染色
図5. ヒト培養骨髄細胞の酒石酸耐性酸性ホスファターゼおよびアルカリ性ホスファターゼ活性染色