CRISPR/Cas9システムを利用した一塩基置換細胞の作製実施例
ゲノム編集技術を用いたノックイン細胞や一塩基置換細胞の作製は、非常に効率が低いことが問題となっています。タカラバイオでは、ゲノム編集による一塩基置換には編集箇所の再切断を防ぐことが重要であることを証明し、一本鎖オリゴDNA(ssODN)のデザインの最適化を行いました。また、Cas9/gRNA ribonucleoprotein(RNP)の使用が編集箇所の再切断を防ぐことも明らかとし、より高効率に変異株を取得する技術を開発しています。
■ 高効率なゲノム編集法の開発
293T/17細胞にZsGreen1発現ベクターを導入し、開始コドンの一塩基置換による、ゲノム編集細胞評価系を作製し、ssODNのデザインを最適化しました。さらに、Cas9とsgRNAの導入を、プラスミドDNA発現ベクターからRNPに変えることにより、高効率に一塩基置換株を作製できることを確認しました(1.2% → 22.8%/1 copyモデル細胞、2.3% → 28.0%/2 copyモデル細胞)。
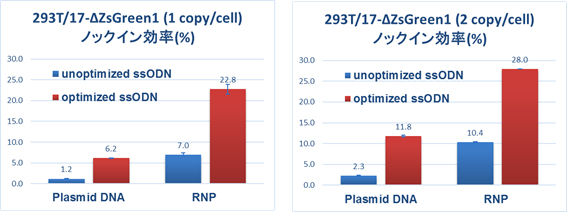

■ 293T/17細胞 (ATCC CRL-11268) 3倍体での一塩基置換細胞取得実績
最適化したssODNを使用して、プラスミドDNA又はRNPによる一塩基置換細胞取得を行いました。35ターゲット中、33ターゲットで目的置換株(ホモ又はヘテロ、2ターゲットは目的変異+InDel)を取得できました。特に、RNPによる導入では目的変異株の取得効率が向上しました。
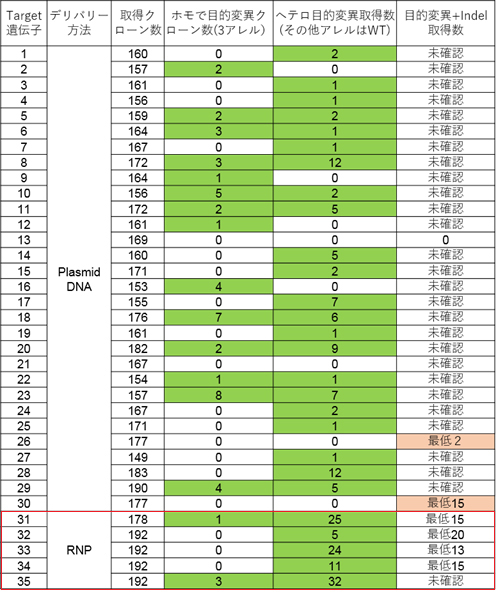
※ 国立医薬品食品衛生研究所 鈴木孝昌先生ご提供データ

※ 国立医薬品食品衛生研究所 鈴木孝昌先生ご提供データ
