【ユーザー様実施例4】 マイコプラズマ感染細胞の細胞とマイコプラズマのDNAコピー数の推移
データご提供:東海大学 医学部 臨床検査学 柿添 英文 様
■ 実験の概要
マイコプラズマに感染した培養細胞とマイコプラズマのDNAコピー数をリアルタイムPCRで測定した。 当実験室で培養している浮遊細胞のRPMI液体培地にマイコプラズマのPPLO液体培地のコンフルエント液を添加し、一日ごとに培地をサンプリングした。液体培地よりDNAを抽出し、培養細胞のGAPDHの測定用プライマーとマイコプラズマp1プライマーでTB Green Premix Ex Taq II (Tli RNaseH Plus)試薬、LightCycler480を用いて測定した。■ 結果
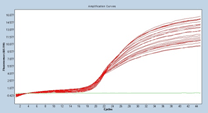
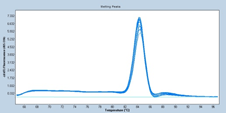
培養細胞GAPDHの増幅曲線と融解曲線
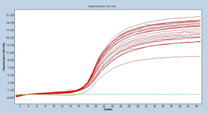
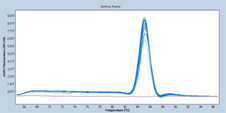
マイコプラズマp1の増幅曲線と融解曲線
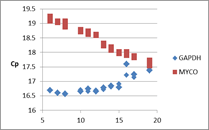
各qPCRでのCp値の推移
マイコプラズマは対数的に増加して、培養細胞数は緩やかに減少していると考えられる。培地中の細胞数カウントでも生細胞数は感染していない細胞と比較してもすぐには減少しないという経験とも矛盾しない結果であった。
ちなみに、同じDNAサンプルをB社の試薬でStepOneでランをしたところ、以下のような結果となった。
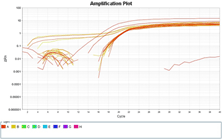
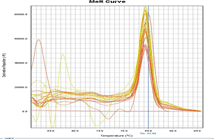
培養細胞GAPDHの増幅曲線と融解曲線
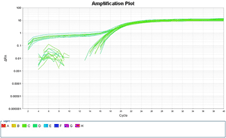
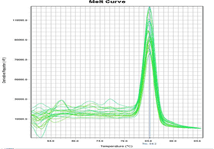
マイコプラズマp1の増幅曲線と融解曲線
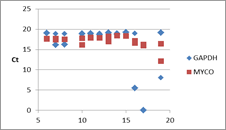
各qPCRでのCp値の推移
B社のインターカレーター法の試薬では同じサーマルサイクラーを推奨しておらず、LightCyclerでの比較ができず、機器による違いなのか、試薬による違いなのかは今後の検討材料となる。
当実験室では伝統的に培養細胞の感染・コンタミの検出にTB Green Premix Ex Taq II (Tli RNaseH Plus)が使用されていきたが、現段階ではTB Green Premix Ex Taq II (Tli RNaseH Plus)とLightCyclerでの測定の方が感度、定量性ともに優れており、引き続きこの方法を採用する。
■ TB Green Premix Ex Taq II (Tli RNaseH Plus)を使った感想はいかがでしたか?
予めバッファーと酵素がプレミックスとなっており、条件がそろっていれば試薬の調製が簡単でエラーが起こりにくく使いやすいです。当実験室では他の2step-RT-qPCRの際にもこの試薬を用いた系を採用しており、試薬の共通化という意味でマイコプラズマの検出や測定にも同試薬を用いていますが、どちらの目的にも優れた結果を出しており、汎用性も高い試薬で安心して使えると感じております。
