Poly(A)配列以降の残余塩基数と翻訳効率の関係性
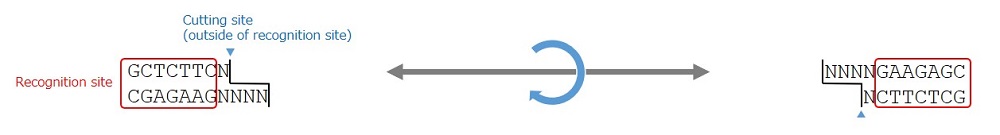
図1. BspQ I の認識配列と切断箇所、および反転イメージ
Type IIS制限酵素であるBspQ Iの認識配列(赤枠)と切断サイト(青矢頭)。切断サイトは認識配列の外側に位置する。
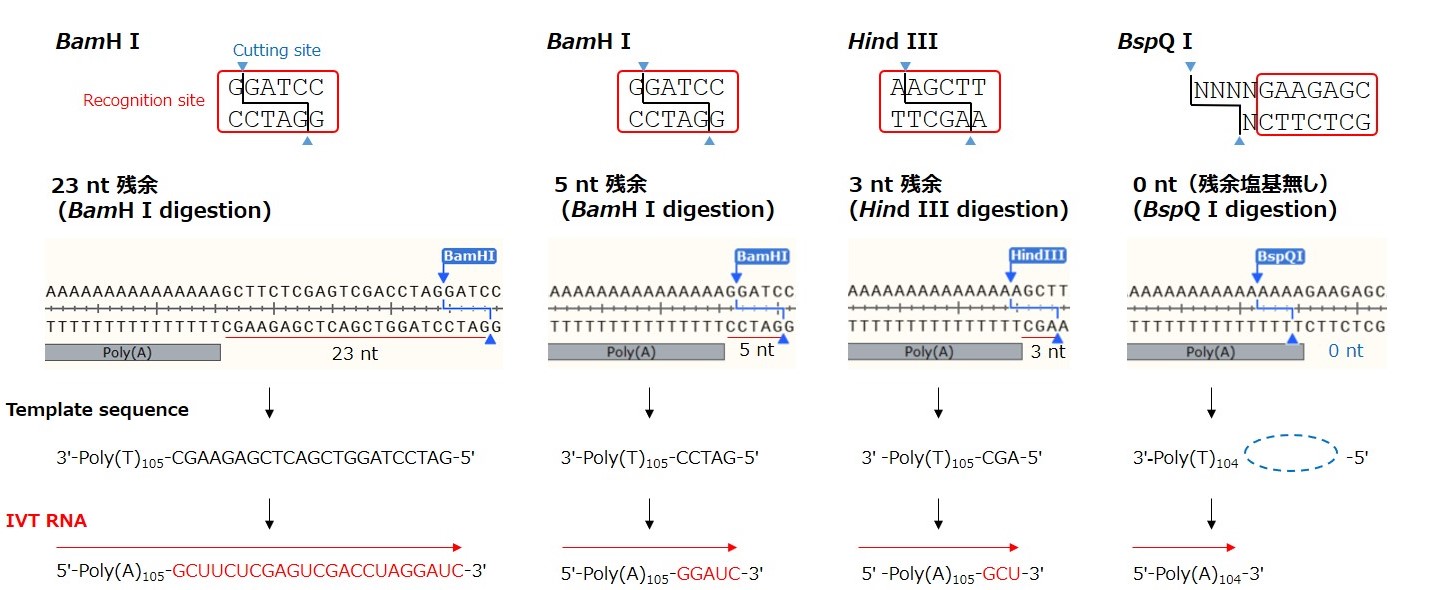
図2. Poly(A)含有IVT鋳型DNAプラスミドの制限酵素認識配列デザイン、線状化後の末端構造、およびIVT RNA配列
Poly(A)配列以降の残余塩基数の影響を検討するために、制限酵素処理後にPoly(A)配列後の残存塩基数が異なるプラスミド鋳型を用意し、CleanCap Reagent AG (3ʹ OMe)およびN1-メチルシュードUTPを含むIVT反応でFLuc mRNAを合成した。IVT RNAのPoly(A)以降の残余塩基配列は赤文字で示している。
※Hind III(3 nt残余)のデザインは、Linearized Template Vector(製品コード 6143のコンポーネント)と同一
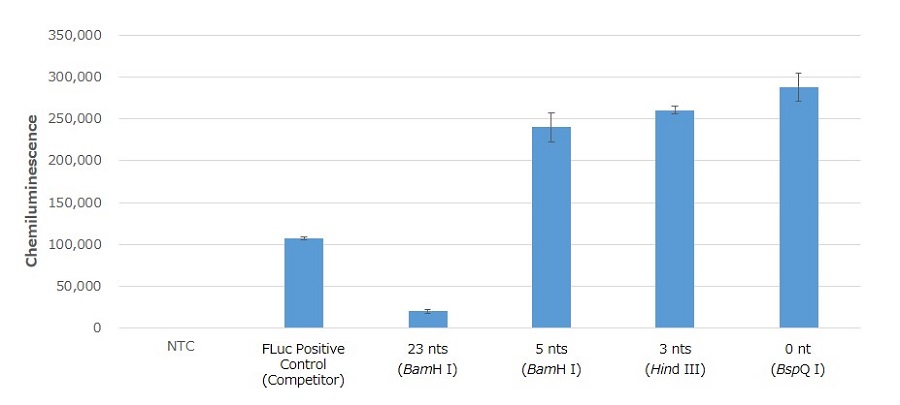
図3. HEK293T細胞における、Poly(A)配列以降の残余塩基数が及ぼすmRNA翻訳効率への影響検討
得られたRNAの0.5 μgをTransIT-mRNA Transfection Reagentを用いてHEK293T細胞にトランスフェクションした。24時間後の細胞を回収し、FLucの活性を測定したところ、23塩基が残存するプラスミド鋳型から調製したmRNAでは、他と比べ活性が著しく低下していた。
一方、残存塩基が5塩基以下である場合はいずれも高活性を示し、大差はないものの残存塩基が少なくなるにつれ活性が若干高くなる傾向が見られた。残余塩基数が0 ntの時に翻訳効率が最大となることから、mRNA合成を目的とする鋳型DNAプラスミドのデザイン時はBspQ IなどのType IIS制限酵素の使用が推奨される。
※Poly(A)配列直下の残余塩基が3塩基となるHind IIIで直鎖化した場合、若干翻訳効率が下がるものの、残余塩基 0 ntの結果と大差は認められなかった。
