- 細胞ペレットから1時間半以内に精製が可能
- 1012 ウイルス粒子を精製可能
- 塩化セシウムを用いた超遠心操作は不要
Adeno-X Maxi Purification Kitは組換えアデノウイルスの精製を1時間半以内に行えるクロマトグラフィーベースのシステムである。手順は簡便で、スケールアップやスケールダウンも簡単である。
プロトコールに超遠心の工程はない。そのかわり、アデノウイルスを選択的に結合するユニークなメンブレン吸着剤を使用するクロマトグラフィーによりアデノウイルスを精製する。このメンブレンは標準サイズのBD Luer-Lokシリンジにフィットする小型の使い捨てカートリッジ内に収められている。このシリンジとフィルターは予め完全に組み立てられているので、すぐに使用できる。また、一方向バルブを採用しているため、アデノウイルスを含む培地およびフィルターを通過した洗浄液を捨てる際にシリンジをはずす面倒な操作は不要である。アデノウイルスを含む培地を一方向バルブからシリンジ内に入れ、精製フィルターカートリッジを通すように押し出すだけの非常に簡単な操作である。
回収から精製までの全プロトコールの所要時間は、わずか1時間から1時間半である(図1)。細胞の形態が完全に変化したら細胞を回収、溶解し遠心する。続いて、その上清をBenzonase Nucleaseで処理して核酸を消化し、プレフィルターで清澄化する。次に、ウイルスを含む抽出液を精製用カートリッジを通して押し出す。この時、アデノウイルスがフィルターに結合する。結合したウイルスを少量の溶出バッファーで溶出すれば、操作は完了である。
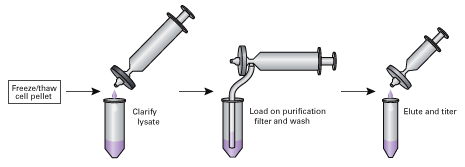
図1. Adeno-X Maxi Purificationのプロトコール
Adeno-X Maxi Kitは操作が簡単で経済的
Adeno-X Maxi Purification Kitのプロトコールは、細胞ペレットから直接、最大量のアデノウイルス精製が可能となるようにデザインされている。2検体および6検体用があり経済的である。プロトコールに超遠心の工程はない。そのかわり、アデノウイルスを選択的に結合するユニークなメンブレン吸着剤を使用するクロマトグラフィーによりアデノウイルスを精製する。このメンブレンは標準サイズのBD Luer-Lokシリンジにフィットする小型の使い捨てカートリッジ内に収められている。このシリンジとフィルターは予め完全に組み立てられているので、すぐに使用できる。また、一方向バルブを採用しているため、アデノウイルスを含む培地およびフィルターを通過した洗浄液を捨てる際にシリンジをはずす面倒な操作は不要である。アデノウイルスを含む培地を一方向バルブからシリンジ内に入れ、精製フィルターカートリッジを通すように押し出すだけの非常に簡単な操作である。
回収から精製までの全プロトコールの所要時間は、わずか1時間から1時間半である(図1)。細胞の形態が完全に変化したら細胞を回収、溶解し遠心する。続いて、その上清をBenzonase Nucleaseで処理して核酸を消化し、プレフィルターで清澄化する。次に、ウイルスを含む抽出液を精製用カートリッジを通して押し出す。この時、アデノウイルスがフィルターに結合する。結合したウイルスを少量の溶出バッファーで溶出すれば、操作は完了である。

図1. Adeno-X Maxi Purificationのプロトコール
高品質・高力価のウイルスの調製を達成
簡略化された新しいプロトコールでは、ウイルスを直接、細胞ペレットから精製する。図2のデータには、ウイルスのほとんどが感染2日目は上清中ではなく細胞内部に存在することが示されている。従って、上清も細胞ペレットと合わせて精製してもプロトコールが不必要に複雑になるだけで、得られるウイルス量はそれほど増加しないと考えられる。
Adeno-X Purification kitsから得られるウイルスは、CsCl密度勾配遠心法で得られるウイルスと同レベルの高い力価と純度を示し、ウイルスと感染単位の比率は20:1となっている。CsClを用いる方法と異なり、特別なトレーニングや高価な機器は必要ない。簡単な操作だけで純度の高いアデノウイルスを高収率かつ高い再現性で精製することができる。使用する組換えアデノウイルスのバックボーンや発現する目的タンパク質の毒性によって異なるが、Adeno-X Maxi Purification Kitは、アデノウイルスを最大1012個まで調製することができる。Adeno-X purification kitsはいずれも、高い回収率(図3)が得られ、ウイルス粒子数/感染単位(IFU)比率が低い高純度・高品質のアデノウイルスを精製可能である。
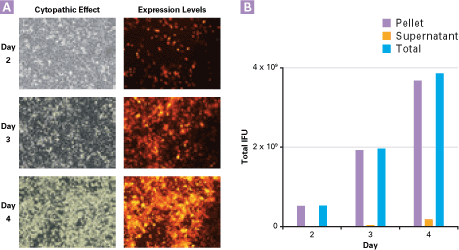
図2. ウイルス感染後の細胞ペレットと培養上清中から得られるウイルス力価の経時的な変化と細胞変性効果(CPE)
HEK 293細胞を、6ウェルプレートに1×105 cells/cm2、0.28 ml/cm2密度で播いて16時間培養し、DsRed-Expressを発現するウイルス(Adeno-X Expression System2を用いて作製)を、MOI=1~2で感染させ、2~4日間培養を行った。
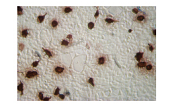
パネルA:ウイルスを感染させたHEK 293細胞の細胞変性効果(CPE)を感染後2~4日間観察した(図左:光学顕微鏡で観察、図右:DsRED-Express発現による蛍光を観察)。4日目にFull CPEに近い状態が観察されている。
パネルB:感染2~4日後の各日に、細胞ペレットとその培養上清からウイルスを調製した。細胞ペレットは新たな培地で懸濁後、凍結融解を3回行い、残渣を遠心操作で除いた。ウイルス力価はHEK 293細胞に感染させた48時間後に、蛍光顕微鏡で細胞数を測定して求めた。感染後の各日数で細胞ペレットと培養上清中のウイルス量を比較したところ、いずれの培養日数に於いても細胞ペレット中に大部分のウイルスが見られ、最大のウイルス量が得られた感染4日目においても培養上清から得られるウイルス量は2%程度に過ぎなかった。
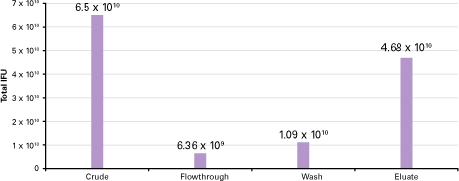
図3. 精製各ステップで残存するウイルス量
図2と同様に、HEK 293細胞にDsRed-Expressを発現するウイルスを感染させ、完全なCPEに近い状態から細胞を回収した。その後、Adeno-X Maxi Purification Kitの操作手順に従いウイルス精製を行った。精製前、カラムを通した吸着バッファー、洗浄バッファー、および溶出バッファーについて、図2と同様の方法でウイルス力価を測定した。 精製前(粗精製)の72%のウイルス粒子がカラムより溶出回収でき、1時間で4.68×1010のウイルスが精製された。
Adeno-X Purification kitsから得られるウイルスは、CsCl密度勾配遠心法で得られるウイルスと同レベルの高い力価と純度を示し、ウイルスと感染単位の比率は20:1となっている。CsClを用いる方法と異なり、特別なトレーニングや高価な機器は必要ない。簡単な操作だけで純度の高いアデノウイルスを高収率かつ高い再現性で精製することができる。使用する組換えアデノウイルスのバックボーンや発現する目的タンパク質の毒性によって異なるが、Adeno-X Maxi Purification Kitは、アデノウイルスを最大1012個まで調製することができる。Adeno-X purification kitsはいずれも、高い回収率(図3)が得られ、ウイルス粒子数/感染単位(IFU)比率が低い高純度・高品質のアデノウイルスを精製可能である。

図2. ウイルス感染後の細胞ペレットと培養上清中から得られるウイルス力価の経時的な変化と細胞変性効果(CPE)
HEK 293細胞を、6ウェルプレートに1×105 cells/cm2、0.28 ml/cm2密度で播いて16時間培養し、DsRed-Expressを発現するウイルス(Adeno-X Expression System2を用いて作製)を、MOI=1~2で感染させ、2~4日間培養を行った。
パネルA:ウイルスを感染させたHEK 293細胞の細胞変性効果(CPE)を感染後2~4日間観察した(図左:光学顕微鏡で観察、図右:DsRED-Express発現による蛍光を観察)。4日目にFull CPEに近い状態が観察されている。
パネルB:感染2~4日後の各日に、細胞ペレットとその培養上清からウイルスを調製した。細胞ペレットは新たな培地で懸濁後、凍結融解を3回行い、残渣を遠心操作で除いた。ウイルス力価はHEK 293細胞に感染させた48時間後に、蛍光顕微鏡で細胞数を測定して求めた。感染後の各日数で細胞ペレットと培養上清中のウイルス量を比較したところ、いずれの培養日数に於いても細胞ペレット中に大部分のウイルスが見られ、最大のウイルス量が得られた感染4日目においても培養上清から得られるウイルス量は2%程度に過ぎなかった。

図3. 精製各ステップで残存するウイルス量
図2と同様に、HEK 293細胞にDsRed-Expressを発現するウイルスを感染させ、完全なCPEに近い状態から細胞を回収した。その後、Adeno-X Maxi Purification Kitの操作手順に従いウイルス精製を行った。精製前、カラムを通した吸着バッファー、洗浄バッファー、および溶出バッファーについて、図2と同様の方法でウイルス力価を測定した。 精製前(粗精製)の72%のウイルス粒子がカラムより溶出回収でき、1時間で4.68×1010のウイルスが精製された。
内容
・1×Equilibration Buffer
・1×Dilution Buffer
・1×Wash Buffer
・1×Elution Buffer
・Benzonase Nuclease(25 U/ml)
・Syringe-Tip Prefilter
・Adeno-X Maxi Purification Assembly
・Syringes(5 and 20 ml)
・1×Dilution Buffer
・1×Wash Buffer
・1×Elution Buffer
・Benzonase Nuclease(25 U/ml)
・Syringe-Tip Prefilter
・Adeno-X Maxi Purification Assembly
・Syringes(5 and 20 ml)
保存
Benzonase Nuclease:-20℃
その他のコンポーネント:室温
その他のコンポーネント:室温
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。