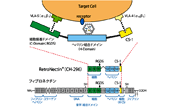
- N末、C末融合発現タイプとIRESを介する同時発現タイプを用意
- レトロウイルスによる効率的な導入
- 融合発現タイプは自己不活性化型ベクター
目的タンパク質のN末あるいはC末に蛍光タンパク質を融合して発現する自己不活性化タイプのpRetroQ-FP-C1(or N1)ベクターと、IRESを介して目的タンパク質と蛍光タンパク質(FP)を同時に発現するpRetroX-IRES-FPベクターを用意している。
蛍光タンパク質を融合発現する自己不活性化レトロウイルスベクター
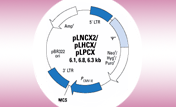
pRetroQ-FP-C1(or N1)ベクターは、赤色(DsRed-Monomer、mCherry)あるいは緑色(AcGFP1)の単量体蛍光タンパク質を目的タンパク質との融合体として発現するように設計されたレトロウイルスベクターである。これらのベクターのバックボーンはQベクターシリーズに由来しており、高いウイルス力価と確実な発現レベルを実現する自己不活性化タイプである。宿主ゲノムに組み込まれた後は、CMVプロモーターにより蛍光融合タンパク質が高レベルで発現し、PGKプロモーターにより感染陽性細胞の選択のためのピューロマイシン選択マーカーが発現する。
これらのベクターは、トランスフェクションおよび感染のマーカーとして使用でき、また、フローサイトメトリーや蛍光顕微鏡などのマルチカラーアプリケーションにも適している(図2)。
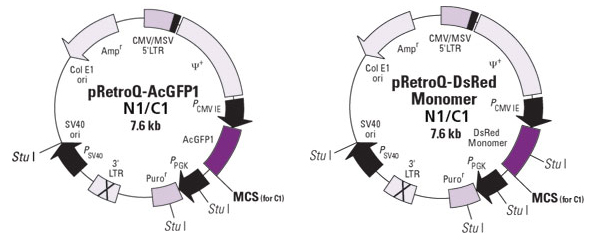
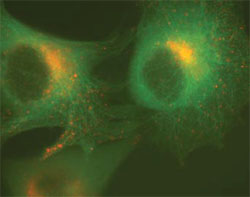
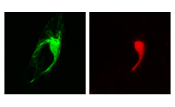
図2. Retro-X Living Colors Fusion Vectorsの組み合わせは二重安定細胞株の作製に理想的
pRetroQ-DsRed-Monomer-GolgiとpRetroQ-AcGFP1-TubulinのコンストラクトをそれぞれGP2-293細胞にトランスフェクトし、48時間後にVSV-Gエンベロープ型ウイルスを回収した。これらのウイルスストックを用いて、HeLa細胞を同時感染させ、その48時間後に蛍光顕微鏡により感染を可視化した。
これらのベクターは、トランスフェクションおよび感染のマーカーとして使用でき、また、フローサイトメトリーや蛍光顕微鏡などのマルチカラーアプリケーションにも適している(図2)。

図1. Retro-X Living Colors Fusion Vectors

図2. Retro-X Living Colors Fusion Vectorsの組み合わせは二重安定細胞株の作製に理想的
pRetroQ-DsRed-Monomer-GolgiとpRetroQ-AcGFP1-TubulinのコンストラクトをそれぞれGP2-293細胞にトランスフェクトし、48時間後にVSV-Gエンベロープ型ウイルスを回収した。これらのウイルスストックを用いて、HeLa細胞を同時感染させ、その48時間後に蛍光顕微鏡により感染を可視化した。
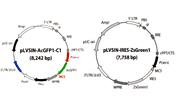
IRESを介して蛍光タンパク質を同時発現するレトロウイルスベクター
Retro-X IRES Living Colors Vectorsは、明るい赤色(DsRed-Express)または緑色(ZsGreenl)蛍光マーカーと目的遺伝子を効率よく共発現できるようにデザインされている。この共発現はリボソーム内部侵入部位(IRES)を含むバイシストロニックな転写産物を利用している。IRESにより、1つのmRNAから2種類のタンパク質が独立して翻訳される(図3)。
異なるプロモーターを利用する遺伝子の共発現はプロモーター間で競合が生じ、最終的に1つのプロモーターが抑制されることになる。一方、本ベクターでは1つのプロモーターを使用し、IRESを含むバイシストロニックなmRNAの翻訳を誘導している。IRESは内部の開始部位からcap非依存的な翻訳を開始させるため、目的タンパク質と蛍光マーカータンパク質を安定に共発現させることができる。
目的遺伝子と蛍光マーカーの共発現には他にもいくつかの利点がある。第1に、蛍光マーカーによりフローサイトメトリーや蛍光顕微鏡による検出が可能で(図4)、遺伝子導入および形質導入の効率を簡単に測定することができる。第2に、これら2つのタンパク質は1つのmRNAから翻訳されるため、簡単に検出可能な蛍光マーカーの発現レベルを基に目的遺伝子の発現レベルを求めることができる。第3に、蛍光マーカーを用いれば目的遺伝子の発現細胞の濃縮にフローサイトメトリーを使用できる。これは目的遺伝子を遺伝子導入が困難な細胞に導入する際には特に有用である(図5)。さらに、蛍光細胞数の計測またはフローサイトメトリーにより、ウイルスストックの感染力価を短時間で測定することが可能である。
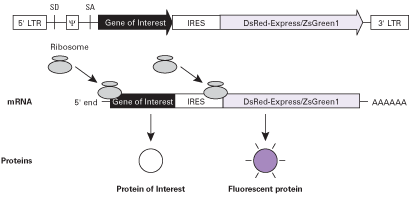
図3. バイシストロニックなmRNAの翻訳の模式図
リボソーム内部侵入部位(IRES)により、目的タンパク質と蛍光タンパク質が同じmRNAから独立して翻訳される。S.D.=スプライスドナー、S.A.=スプライスアクセプター、Ψ=パッケージングシグナル、LTR=長末端反復配
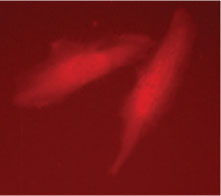
図4. Retro-X IRES Living Colors Vectorsは感染細胞の可視化に最適
pRetroX-MetLuc-IRES-DsRed-Express(Metridia分泌型ルシフェラーゼをコード;5)をGP2-293細胞に遺伝子導入し、72時間後にVSV-G-偽型レトロウイルスを回収した。このウイルスストックを用いてHeLa細胞を感染させ(MOI=10)、96時間後、蛍光顕微鏡を用いて発現を観察した。MOI=多重感染度
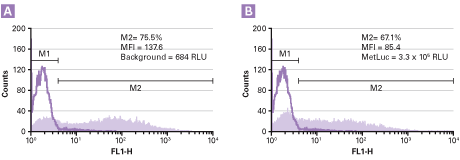
図5. 遺伝子導入が困難な細胞においても極めて高い感染効率を達成
GP2-293パッケージング細胞にpVSV-GおよびpRetroX-IRES-ZsGreen1(陰性対照)またはpRetroX-MetLuc-IRES-ZsGreen1(Metridia分泌型ルシフェラーゼをコード)を同時に遺伝子導入した。得られたVSV-G偽型ウイルスをRetroNectinコーティングプレート上でJurkat細胞に感染させた。感染後96時間目にMetlucおよびZsGreen 1の発現をそれぞれ照度測定およびフローサイトメトリーにより測定した。
パネルA:pRetroX-IRES-ZsGreen1を導入したJurkat細胞の分析
パネルB:pRetroX-MetLuc-IRES-ZsGreen1を導入したJurkat細胞の分析
MFI=平均蛍光強度、RLU=相対発光量、M1=ベクターを導入していない細胞を識別するゲート、M2=ベクターを形質導入した細胞を識別するゲート
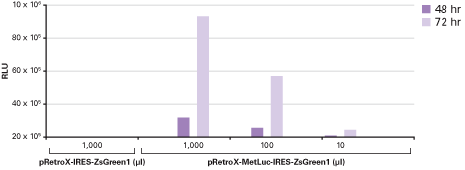
図6. Retro-X IRES Living Colors Vectorsは目的遺伝子と蛍光マーカーを高レベルに共発現
GP2-293パッケージング細胞をpVSV-GおよびpRetroX-IRES-ZsGreen1(陰性対照)またはpRetroX-MetLuc-IRES-ZsGreen1(Metridia分泌型ルシフェラーゼをコード)のどちらかと同時遺伝子導入した。得られたVSV-Gシュードウイルスを導入後72時間目に回収した。このVSV-Gシュードウイルスストックの1,000 μl、100 μl、または10 μlをHeLa細胞に感染させた。MetLuc(単位は相対発光量、RLU)の測定を感染後48時間および72時間目に実施し、ZsGreen1由来の平均蛍光強度(MFI)を感染後72時間目に測定した。ウイルス力価は蛍光細胞のパーセンテージに基づき、約1×107 IFU/mlと算出された(データは示していません)。これらの結果から、pRetroX-IRES-ZsGreen1ベクターから高力価のウイルスが産生され、高レベルのタンパク質が共発現されていることが確認された。
異なるプロモーターを利用する遺伝子の共発現はプロモーター間で競合が生じ、最終的に1つのプロモーターが抑制されることになる。一方、本ベクターでは1つのプロモーターを使用し、IRESを含むバイシストロニックなmRNAの翻訳を誘導している。IRESは内部の開始部位からcap非依存的な翻訳を開始させるため、目的タンパク質と蛍光マーカータンパク質を安定に共発現させることができる。
目的遺伝子と蛍光マーカーの共発現には他にもいくつかの利点がある。第1に、蛍光マーカーによりフローサイトメトリーや蛍光顕微鏡による検出が可能で(図4)、遺伝子導入および形質導入の効率を簡単に測定することができる。第2に、これら2つのタンパク質は1つのmRNAから翻訳されるため、簡単に検出可能な蛍光マーカーの発現レベルを基に目的遺伝子の発現レベルを求めることができる。第3に、蛍光マーカーを用いれば目的遺伝子の発現細胞の濃縮にフローサイトメトリーを使用できる。これは目的遺伝子を遺伝子導入が困難な細胞に導入する際には特に有用である(図5)。さらに、蛍光細胞数の計測またはフローサイトメトリーにより、ウイルスストックの感染力価を短時間で測定することが可能である。

図3. バイシストロニックなmRNAの翻訳の模式図
リボソーム内部侵入部位(IRES)により、目的タンパク質と蛍光タンパク質が同じmRNAから独立して翻訳される。S.D.=スプライスドナー、S.A.=スプライスアクセプター、Ψ=パッケージングシグナル、LTR=長末端反復配

図4. Retro-X IRES Living Colors Vectorsは感染細胞の可視化に最適
pRetroX-MetLuc-IRES-DsRed-Express(Metridia分泌型ルシフェラーゼをコード;5)をGP2-293細胞に遺伝子導入し、72時間後にVSV-G-偽型レトロウイルスを回収した。このウイルスストックを用いてHeLa細胞を感染させ(MOI=10)、96時間後、蛍光顕微鏡を用いて発現を観察した。MOI=多重感染度

図5. 遺伝子導入が困難な細胞においても極めて高い感染効率を達成
GP2-293パッケージング細胞にpVSV-GおよびpRetroX-IRES-ZsGreen1(陰性対照)またはpRetroX-MetLuc-IRES-ZsGreen1(Metridia分泌型ルシフェラーゼをコード)を同時に遺伝子導入した。得られたVSV-G偽型ウイルスをRetroNectinコーティングプレート上でJurkat細胞に感染させた。感染後96時間目にMetlucおよびZsGreen 1の発現をそれぞれ照度測定およびフローサイトメトリーにより測定した。
パネルA:pRetroX-IRES-ZsGreen1を導入したJurkat細胞の分析
パネルB:pRetroX-MetLuc-IRES-ZsGreen1を導入したJurkat細胞の分析
MFI=平均蛍光強度、RLU=相対発光量、M1=ベクターを導入していない細胞を識別するゲート、M2=ベクターを形質導入した細胞を識別するゲート

図6. Retro-X IRES Living Colors Vectorsは目的遺伝子と蛍光マーカーを高レベルに共発現
GP2-293パッケージング細胞をpVSV-GおよびpRetroX-IRES-ZsGreen1(陰性対照)またはpRetroX-MetLuc-IRES-ZsGreen1(Metridia分泌型ルシフェラーゼをコード)のどちらかと同時遺伝子導入した。得られたVSV-Gシュードウイルスを導入後72時間目に回収した。このVSV-Gシュードウイルスストックの1,000 μl、100 μl、または10 μlをHeLa細胞に感染させた。MetLuc(単位は相対発光量、RLU)の測定を感染後48時間および72時間目に実施し、ZsGreen1由来の平均蛍光強度(MFI)を感染後72時間目に測定した。ウイルス力価は蛍光細胞のパーセンテージに基づき、約1×107 IFU/mlと算出された(データは示していません)。これらの結果から、pRetroX-IRES-ZsGreen1ベクターから高力価のウイルスが産生され、高レベルのタンパク質が共発現されていることが確認された。
保存
-20℃
| 注意: | IRES配列上流のMCSに翻訳されるORFをクローニングしていない状態では、蛍光タンパク質の発現が弱く、蛍光顕微鏡による検出が難しい場合がある。IRES前のMCSに約0.7~1.2 kbの遺伝子を挿入して使用することをお勧めする。 |
BIO VIEW / Clontechniques
多重発光スクリーニング用途の貴重なツール(4色で同時に観察例)
シアン、緑、黄、赤の4色が選べる4種類の新規タンパク質(FACSで4色同時に分離した例)
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。