リゾスフィンゴ脂質や標識スフィンゴ脂質の調製が簡単に!
製品説明
本製品はスフィンゴ脂質に作用して、リゾスフィンゴ脂質と脂肪酸を生成する酵素である1)。
さらに、リゾ体と脂肪酸からスフィンゴ脂質を合成する縮合反応およびスフィンゴ脂質の脂肪酸を交換する反応も効率よく行うことができる2)。
基質特異性として、GM1, Globoside, Sulfatide など、幅広い酸性および中性スフィンゴ糖脂質によく作用する。また、スフィンゴミエリンにもよく作用する。
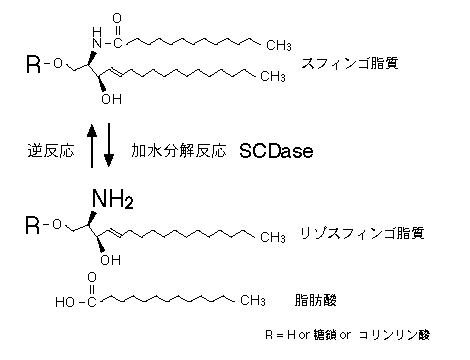
基質特異性として、GM1, Globoside, Sulfatide など、幅広い酸性および中性スフィンゴ糖脂質によく作用する。また、スフィンゴミエリンにもよく作用する。

保存
-20℃以下(凍結融解は繰り返さない。融解後、必要量ずつ分注して、凍結保存することが望ましい。)
酵素番号
3.5.1.69
由来
Pseudomonas sp.
形状
溶液凍結品[0.1% Lubrol PXを含む50 mM酢酸ナトリウム緩衝液 (pH6.0)]
活性の定義
下記の条件で1分間に1 μmolのlyso-GM1を生成する酵素活性を1 Uとする。
活性測定方法
本製品、2 nmolのGM1、および0.8% Triton X-100を含む50 mM酢酸ナトリウム緩衝液(pH6.0)10 μlの反応液を37℃で15分間インキュベートした後、反応液をTLCで展開する。オルシノール硫酸で糖脂質を発色させ、イメージアナライザーで分解率を測定する。
一般的性質
酸性pH、高濃度界面活性剤存在下では加水分解反応が優先的に進行し、
中性pH、低濃度界面活性剤存在下では縮合反応が優先的に進行する。
中性pH、低濃度界面活性剤存在下では縮合反応が優先的に進行する。
| 至適pH : | 加水分解反応 | pH 5.0~6.0(0.8% Triton X-100) |
| 縮合反応 | pH 7.0(0.1% Triton X-100) | |
| 阻害剤 : | Hg2+, Zn2+, Cu2+で阻害される。 | |
| Mn2+, Ca2+, Mg2+, EDTAでは阻害されない。 | ||
純度
| α-Galactosidase | 検出限界以下 |
| β-Galactosidase | 検出限界以下 |
| α-N-acetylgalactosaminidase | 検出限界以下 |
| β-N-acetylgalactosaminidase | 検出限界以下 |
| β-N-acetylglucosaminidase | 検出限界以下 |
| α-Mannosidase | 検出限界以下 |
| α-Fucosidase | 検出限界以下 |
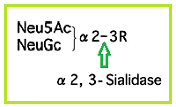
| Sialidase | 検出限界以下 |
| Protease | 検出限界以下 |
| Sphingomyelinase | 検出限界以下 |
| 測定方法 | |
| 【残存Exoglycosidase活性】 | |
| 本酵素20 mUと20 pmol のピリジルアミノ化オリゴ糖とを酢酸緩衝液 pH 6.0、10 μl中にて37℃で16時間反応させた反応液を順相系HPLCで分析した結果、基質(ピリジルアミノ化オリゴ糖)以外のピークを認めなかった。 | |
| 【残存Protease活性】 | |
| 本酵素50 mUと40 μgの標識カゼインとを酢酸緩衝液pH 6.0、40 μl中にて37℃で16時間反応させた結果、基質の分解を認めなかった。 | |
| 【残存Sphingomyelinase活性】 | |
| 本酵素20 mUと15 nmolの標識スフィンゴミエリンを基質として酢酸緩衝液pH 6.0、55 μl中にて37℃で16時間反応させた結果、基質(スフィンゴミエリン)の分解を認めなかった。 | |
用途
●リゾスフィンゴ脂質(リゾ体)の取得
●各種標識スフィンゴ脂質の作製
●スフィンゴ脂質の固定化
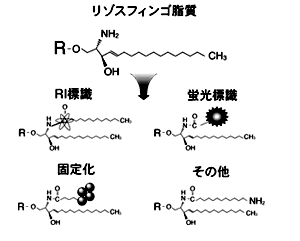
●各種標識スフィンゴ脂質の作製
●スフィンゴ脂質の固定化

Protocols
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。