土壌からのRNA精製プロトコール
NucleoBond RNA Soil(製品コード 740140.20)
| 試薬の調製 | Buffer E1に沈殿がないことを確認する。もし沈殿がある場合には、30~40℃で保温して沈殿を溶解させる。 フェノール:クロロホルム:イソアミルアルコール(容量比25:24:1)溶液を室温に戻し、良く混合しておく。 Buffer E5*1が添付の英文説明書に従って調製されていることを確認する。 |
|
| 1. | サンプルの準備 |  4本のMN Bead Tubes Type Aの1 mlの目盛り線まで、土壌サンプルを入れる*2。 |
| 2. | 溶解バッファーの添加 |  各Bead Tubeに800 μlのBuffer E1を加える。 (オプション:各TubeへさらにBuffer OPT 100 μlを加える。Buffer OPTの添加により、無機質の多い土壌ではRNA回収量の増加が期待できるが、有機物の多い土壌では阻害物の混入が多くなる) さらに100 μlのフェノール:クロロホルム:イソアミルアルコール溶液(添加前によく混合しておく)を加えて、2秒間vortexで混合する。 |
| 3. | サンプルの溶解 |  Bead TubeをVortex mixer上のMN Bead Tube Holderにセットし、室温で5分間最高速度で振盪する*3。 |
| 4. | ライセートの清澄化 |   13,000×g、2分間遠心する。 4本のBead Tubeより上清を集め、新しい15 mlチューブ(各自で用意)に移す。 抽出液のおおよその液量を計測する。 |
| 5. | Bufferの添加 |   抽出液の容量に対して、1/8の液量のBuffer E2を加える。Vortexで5秒間混合する。 室温で2分間静置後、4,500×g、2分間遠心する。 |
| 6. | カラムの平衡化 | 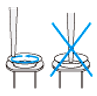 NucleoBond RNA Columnを、Buffer EQU 12 mlで平衡化する。 図に示すように、カラムの縁に沿ってバッファーを注ぐ。液を自然落下させてカラムを空にする。 |
| 7. | カラムへの吸着 |  5. の上清をフィルターの中央に加える。 液を自然落下させてカラムを空にする。このろ液にはフェノール、クロロホルムが含まれるので、適切に処理する。 |
| 8. | フィルターの洗浄 |  Buffer E3 6 mlでフィルターとカラムを洗浄する。 図に示すようにカラムの縁に沿ってバッファーを注ぐ。自然落下させてカラムを空にしたのちフィルターを破棄する。 |
| 9. | カラムの洗浄 |  Buffer E4 8 mlでカラムを洗浄する。 |
| 10. | RNAの溶出 |  Buffer ERNA 5 mlでRNAを溶出する。 溶出液を50 ml遠心チューブ(各自で用意)に集める*4。 |
| 11. | 核酸の沈殿 |  イソプロパノール 3.5 ml(各自で用意)を加えて、vortexで5秒間混合する。 50 mlチューブにセットしたNucleoSpin Finisher Columnに移す。 |
| 12. | 核酸の結合 |   NucleoSpin Finisher Columnを4,500×g、2分間遠心する。ろ液を捨てる。 |
| 13. | カラムの洗浄、乾燥 |   NucleoSpin Finisher Columnの中央にBuffer E5 1mlを加える。 4,500×g、2分間遠心する。 |
| 14. | 核酸の溶出 |   NucleoSpin Finisher Columnを新たな50 mlチューブに移し、RNase-free H2O 100 μlを加え、4,500×g、2分間遠心して核酸を溶出させる。 |
*1
Buffer E5の調製法
製品コード 740140.20(20回用)の場合:Buffer E5 (Concentrate) 6 mlに96~100%エタノール 24 mlを添加する。
製品コード 740140.20(20回用)の場合:Buffer E5 (Concentrate) 6 mlに96~100%エタノール 24 mlを添加する。
*2
4本のBead Tube中のビーズを15 mlのチューブ(各自で用意)に移し、そのチューブに2 gまで(1~1.5 gが最適)の土壌サンプルを入れる。
この場合、3.2 mlのBuffer E1、0.4 mlのフェノール:クロロホルム:イソアミル溶液(オプションとして0.4 ml Buffer OPT)を加えて破砕する。遠心後、上清を新たな15 mlチューブに移して、5.以降のステップを行う。
この場合、3.2 mlのBuffer E1、0.4 mlのフェノール:クロロホルム:イソアミル溶液(オプションとして0.4 ml Buffer OPT)を加えて破砕する。遠心後、上清を新たな15 mlチューブに移して、5.以降のステップを行う。
*3
自動破砕機を用いて、サンプルを破砕してもよい。この場合、破砕条件は使用する機器に合わせて変更する。詳細は英文説明書を参照する。
*4
DNA Set for NucleoBond RNA Soilを使用することでDNAも別途溶出できる。その場合、カラムを別の15 mlのチューブ(各自で用意)に移し、Buffer EDNA 5 mlで溶出させる。その後RNAと同様に精製する。
<注意>
使用前には、詳細なプロトコールは必ず添付の英文説明書で確認すること。
使用前には、詳細なプロトコールは必ず添付の英文説明書で確認すること。
