Brevibacillus Expression Systemを用いた組換え豚丹毒菌抗原タンパク質の生産
豚丹毒菌の組換えタンパク質を用いたワクチン開発を目的として、Brevibacillus choshinensisを宿主として69 kDa感染防御抗原の一部(46.5 kPA:46.5 kDaの防御抗原)の大量生産を試みた。B. choshinensisは菌体外にタンパク質を大量に分泌することを特徴としており1)、低コストでの生産が必須となる家畜用ワクチンの開発には最適であると考えられる。
さらに生産された組換えタンパク質抗原を用いて豚丹毒菌の感染、発現防御能を評価し、ワクチンとしての有効性を確認した。(ヒゲタ醤油株式会社より実施データ提供)
※豚丹毒菌Erysipelothrix rhusiopathiaeは豚、イノシシ、鯨類、鶏、七面鳥などの食用動物に病原性を持ち、畜産の生産性に大きな被害を与えていた。また、本菌は人にも病原性を持つこと、食肉処理場で多数の豚丹毒症例が摘発されることから食品の安全性にも脅威となっている。
現在、豚丹毒の予防には弱毒生菌、不活化全菌体、菌体抽出タンパク質を有効成分とするワクチンが使われている。しかし、重篤な副作用や病原性の残留等が問題となっていた。すでに本菌から感染防御活性を有する69 kDaタンパク質SpaAの遺伝子が単離されているが2)、組換え抗原を主成分とするワクチンは実用化されていない。また、今田ら3)により強毒株Fujisawa株より69 kDa感染防御抗原のうち感染防御に必要な領域が決定された。
さらに生産された組換えタンパク質抗原を用いて豚丹毒菌の感染、発現防御能を評価し、ワクチンとしての有効性を確認した。(ヒゲタ醤油株式会社より実施データ提供)
※豚丹毒菌Erysipelothrix rhusiopathiaeは豚、イノシシ、鯨類、鶏、七面鳥などの食用動物に病原性を持ち、畜産の生産性に大きな被害を与えていた。また、本菌は人にも病原性を持つこと、食肉処理場で多数の豚丹毒症例が摘発されることから食品の安全性にも脅威となっている。
現在、豚丹毒の予防には弱毒生菌、不活化全菌体、菌体抽出タンパク質を有効成分とするワクチンが使われている。しかし、重篤な副作用や病原性の残留等が問題となっていた。すでに本菌から感染防御活性を有する69 kDaタンパク質SpaAの遺伝子が単離されているが2)、組換え抗原を主成分とするワクチンは実用化されていない。また、今田ら3)により強毒株Fujisawa株より69 kDa感染防御抗原のうち感染防御に必要な領域が決定された。
【方法および結果】
- B. choshinensisを用いた豚丹毒菌抗原の生産菌構築
発現用宿主菌にB. choshinensis HPD31*を用い、分泌発現用ベクターにpNY326を用いた。抗原タンパク質遺伝子のクローニング、感染防御試験にはE. rhusiopathiae Fujisawa (Serovar1a) を用いた。
E. rhusiopathiae Fujisawaの69 kDa防御抗原遺伝子の感染防御に必要な領域を含む46.5 kPA (30-431番目のアミノ酸領域:1206 bp)をPCR法により増幅しpNY326 DNAにクローニングして、pNY326-46.5 kPA/B. choshinensisを得た(図1)。
* B. choshinensis HPD31:B. choshinensis SP3の元株で、同等の性質を持ちます。
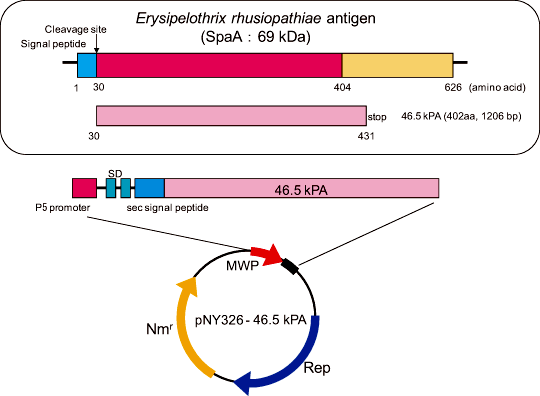
図1. 分泌生産用プラスミドの構築 - 豚丹毒菌抗原46.5 kPAのB. choshinensisによる生産
まず、試験管スケールでの培養試験を行った。TMN培地(3 ml)を用い、30℃で2日間培養し、培養上清のSDS-PAGE分析を行った結果、約0.5 g/Lの生産が認められた。発現された46.5 kPAは抗E. rhusiopathiae抗体を用いたWestern blotでも反応した(図2)。
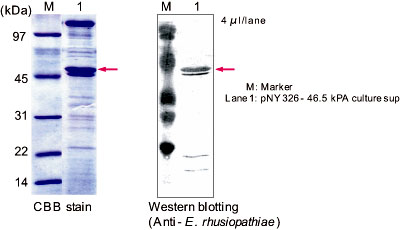
図2. 培養上清のSDS-PAGE分析
次に、30 Lジャーファーメンターを用いての大量培養生産を試みた。TMN培地を用い、33℃、通気1vvm、3日間培養を行ったところ、約0.9 g/Lの生産を示した。図3に示す簡単な工程で精製を行い、SDS-PAGE分析に供した結果、最終サンプルの純度は約80%、培養液からの回収率は45%であった(図4)。

図3. 精製スキーム 図4. 精製品のSDS-PAGE分析
図4. 精製品のSDS-PAGE分析 - 豚における46.5 kPAを用いた感染防御能評価
精製46.5 kPAを用いて調製した試験用ワクチンを接種し、豚丹毒菌のチャレンジ試験を行った。ワクチンを接種した豚には症状が現れず、非接種の豚には明らかな臨床症状が現れた(図5.)。
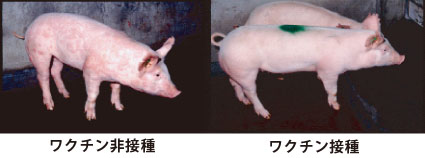
図5. 組換え豚丹毒ワクチンの効果
【まとめ】
B. choshinensisを宿主として、豚丹毒菌E. rhusiopathiae Fujisawa株のSpaAタンパク質の一部46.5 kPAの分泌生産に成功した。30 Lジャーファーメンターでは、さらに高生産を達成し、精製(純度約80%、培養液からの回収率45%)方法も確立された。B. choshinensisはグラム陽性細菌の分泌タンパク質において実績が高く、今回もグラム陽性細菌表層タンパク質の細胞外ドメインがターゲットであったため、好結果に繋がったと考えられる。簡便な精製工程も確立されたことで、低コストでの生産も実現された。
試験用46.5 kPAワクチンは、豚への筋肉内免疫により、血清中に46.5 kPAに対し高レベルのIgG抗体を生産し(データ省略)、E. rhusiopathiaeのチャレンジ試験においても発病を阻止した。
このように、低コストかつ高い免疫防御活性を示したことで、ワクチンとしての製品化が実現された(共立製薬㈱から製造・販売)。今後も、低コストかつ安全性が高められた組換えタンパク質ワクチンの開発が期待される。
試験用46.5 kPAワクチンは、豚への筋肉内免疫により、血清中に46.5 kPAに対し高レベルのIgG抗体を生産し(データ省略)、E. rhusiopathiaeのチャレンジ試験においても発病を阻止した。
このように、低コストかつ高い免疫防御活性を示したことで、ワクチンとしての製品化が実現された(共立製薬㈱から製造・販売)。今後も、低コストかつ安全性が高められた組換えタンパク質ワクチンの開発が期待される。
【参考文献】
- Mizukami, M., et al. Brevibacillus Expression System: Host-Vector System for Efficient Production of Secretory Proteins. Curr. Pharm. Biotechnol. 2010, 11: 251-258.
- Makino et al. Properties of repeat domain found in a novel protective antigen, SpaA, of Erysipelothrix rhusiopathiae. Microb.Pathog., 1998, 25:101-109.
- Imada,Y., et al. Truncated surface protective antigen (SpaA) of Erysipelothrix rhusiopathiae serotype 1a elicits protection against challenge with seroype 1a and 2b in pigs. Infect. Immun. 1999, 67:4376-4382.
