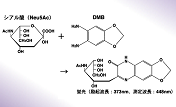
シアル酸の結合を識別
仕様変更のお知らせ
本製品はLot. N201AAより、保存温度が-20℃から4℃に変更になりましたのでご注意ください。
保存
4℃
系統名
Acrylneuraminyl hydrolase
酵素番号
3.2.1.18
由来
Cloned from Salmonella typhimurium LT2 and expressed in Escherichia coli
反応
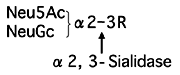
糖鎖中のα-2,3シアリル結合を特異的に切断する。
形状
溶液品〔0.1 M NaCl、0.02%アジ化ナトリウムを含む50 mMリン酸カリウム緩衝液(pH6.8)〕
濃度
50 U/ml
特長
本酵素はクローン体であり、反応時に2価カチオン(Ca2+、Mg2+や安定化剤(BSAなど)の必要がない1,2)。
活性の定義
37℃、pH5.5において、3’-sialyllactoseから1分間に1 μmolのシアル酸を遊離する酵素活性を1 Uとする。
一般的性質
| 分子量 | : | 41,300 |
| ミカエリス定数 | : | Km = 0.25 mM(基質:4MUNeu5Ac*) Km = 2.66 mM(基質:PA-GM3:PA-Sugar Chain 029(製品コード 4129)) * 4MU:4-Methylumbelliferyl |
| 至適pH | : | 5.5-7.0(Tris-maleate緩衝液) 5.5-6.0(リン酸カリウム緩衝液、酢酸ナトリウム緩衝液、Tris-HCl緩衝液) |
| 安定化剤 | : | 特に必要なし |
| 阻害剤 | : | 2-deoxy-2,3-didehydro-N-acetylneuraminic acid Ki = 0.38 mM |
基質特異性
| Substrate | Substrate concentration |
Specific activity (U/mg) |
Method*1 |
| 4MUNeu5Ac | 1.05 mM | 1067.8 | 1 |
| 3'-Sialyllactose | 1 mM | N.T.*2 | 2 |
| 6'-Sialyllactose | 1 mM | N.T.*2 | 2 |
| Colominic acid | 1 mg/ml | N.T.*2 | 2 |
| PA-Sugar chain 029 | 2 μM | 1.81 | 3 |
| PA-Sugar chain 030 | 2 μM | N.D.*3 | 3 |
| PA-Sugar chain 033 | 2 μM | 1.36 | 3 |
| PA-Sugar chain 036 | 2 μM | 0.92 | 3 |
| PA-Sugar chain 022 | 2 μM | 3.05×10-3 | 3 |
| PA-Sugar chain X | 2 μM | N.T.*2 | 3 |
*2 Not Tested (Lot. N201AA-)
*3 Not Detected
PA-Sugar chain X:
Method 1
4MUNeu5Acを基質として下記の条件で酵素反応を行う。
上記反応液を37℃で10分間保持後、反応液2.5 μlに0.1 Mグリシン-水酸化ナトリウム緩衝液(pH10.3)1.5 mlを加えて反応を停止する。励起波長350 nm、測定波長448 nmにおける反応液の蛍光強度を測定し、遊離した4-メチルウンベリフェロンを、標準溶液の蛍光強度と比較することによって定量する。
| <反応液組成> | ||
| 2.1 mM 4MUNeu5Ac | ||
| 50 mM 酢酸ナトリウム緩衝液(pH5.5) | 3 μl | |
| 100 mM NaCl | ||
| 酵素溶液 | 3 μl | |
| 合計反応液量 | 6 μl | |
Method 2
0.1 M酢酸ナトリウム緩衝液(pH5.5)中、酵素標品10 μlを加えて合計反応液量を100 μlとし、37℃で10分間保持後TBA法3)で遊離のシアル酸を定量する。Method 3
近藤らの方法4)によりピリジルアミノ化した糖鎖(PA化糖鎖)を基質として、下記の条件で酵素反応を行う。
上記反応液を37℃で10分間保持後、100℃で3分間加熱することで反応を停止し、HPLC分析に供する。
<HPLC分析条件>
| <反応液組成> | |
| 10 μM PA化糖鎖 | 2 μl |
| 0.1 M 酢酸ナトリウム緩衝液(pH5.5) | 5 μl |
| 酵素溶液 | 3 μl |
| 合計反応液量 | 10 μl |
<HPLC分析条件>
| Column: | PALPAK Type R(4.6 mm |
| Solvent A: | 50 mM acetic acid-triethylamine(pH4.0) |
| Solvent B: | Solvent A containing 0.5% 1-butanol |
| Gradient: | 0→50 min 0→50%B |
| Flow rate: | 1.0 ml/min |
| Detection: | Fluorescence(Ex:320 nm, Em:400 nm) |
| Column temp: | 40℃ |
| Injection: | 5 μl |
純度
1.残存プロテアーゼ活性
本酵素標品10 μlに、0.4 mM酸化インスリンB鎖を含む300 mMリン酸緩衝液(pH7.5)10 μlを加えて、37℃ 16時間反応を行った後、反応液を逆相系HPLCで分析した結果、基質(酸化インスリンB鎖)以外のピークを認めなかった。
2.残存グリコシダーゼ活性
本酵素標品5 μlと糖鎖基質20 pmolとを45 mM酢酸ナトリウム緩衝液(pH5.5最終液量10 μl)中にて37℃16時間反応させた後、100℃で3分間加熱することで反応を停止し、順相系HPLCで分析した結果、基質以外のピークを認めなかった。
残存グリコシダーゼ活性
ND:Not detected
本酵素標品10 μlに、0.4 mM酸化インスリンB鎖を含む300 mMリン酸緩衝液(pH7.5)10 μlを加えて、37℃ 16時間反応を行った後、反応液を逆相系HPLCで分析した結果、基質(酸化インスリンB鎖)以外のピークを認めなかった。
2.残存グリコシダーゼ活性
本酵素標品5 μlと糖鎖基質20 pmolとを45 mM酢酸ナトリウム緩衝液(pH5.5最終液量10 μl)中にて37℃16時間反応させた後、100℃で3分間加熱することで反応を停止し、順相系HPLCで分析した結果、基質以外のピークを認めなかった。
残存グリコシダーゼ活性
| α-Fucosidase | N.D. |
| β-Galactosidase | N.D. |
| α-Mannosidase | N.D. |
| Endo-β-N-acetylglucosaminidase | N.D. |
Application
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。