pAUR101を用いたKluyveromyces marxianus、K. lactis、およびCandida glabrataの形質転換
(1)形質転換効率
方法
染色体組込型ベクターpAUR101をマルチクローニングサイト上のSal Iサイトで1ヵ所切断して直鎖状にした後、Kluyveromyces marxianus IFO1735、K. lactis IFO1267、およびCandida glabrata TIMM1062、TIMM1064に対して形質転換を行った。形質転換は、通常の酢酸リチウム法を簡便化したone-step transformation法5)(Protocol参照)で行った。形質転換体を選択するためには、宿主菌がまったく生育しない最小阻止濃度(MIC)の1.5~3倍濃度のAureobasidin Aを含むYPD寒天プレートを使用した。結果
表1に形質転換効率をまとめた。菌株間で効率にバラツキはみられるが、いずれの株でもAureobasidin A耐性となった形質転換体が得られた。なお、C. glabrata TIMM1062株では形質転換前の培養培地(YPD 又はサブローデキストロース培地;SD)が効率に著しい影響を与えていることから、それぞれの株に最適な条件で形質転換を行えば、更に高い形質転換効率が得られるものと考えられる。
なお、同様の検討をSchizo. pombeについても行ったが、one-step transformation法では形質転換体は得られなかった。
表1. pAUR101 による形質転換効率(one-step transformation)
| 菌株 | MIC (μg/ml) |
AbA選択濃度 (μg/ml) |
形質転換効率 (transformants/μg plasmid) |
培地* |
|---|---|---|---|---|
| S. cerevisiae DKD-5D |
0.2 | 0.5 | 1.2×104 | YPD |
| S. cerevisiae 清酒酵母 |
0.1 | 0.5 | 5.5×103 | YPD |
| C. glabrata TIMM1062 |
0.15 | 0.3 | 84 | YPD |
| C. glabrata TIMM1062 |
0.15 | 0.3 | 0.7×103 | SD |
| C. glabrata TIMM1064 |
0.5 | 0.75 | 82 | SD |
| K. marxianus IFO1735 |
0.2 | 0.5 | 1.4×102 | SD |
| K. lactis IFO1267 |
0.05 | 0.15 | 11 | SD |
* 形質転換前の培養培地
(2)コピー数の確認
結果
形質転換体のゲノムDNAをSph I切断した後にサザンハイブリダイゼーションを行ったところ、1コピーの pAUR101が 染色体に組み込まれた形質転換体では、6.7 kb(pAUR101のサイズ)より大きなサイズのバンドがみられた。また、2コピー以上が繰り返して染色体に組み込まれた形質転換体では、6.7 kbのバンドと6.7 kbより大きなバンドが現れた(図. K. marxianus IFO1735の場合)。その他4種の酵母について結果を表2にまとめた。C. glabrata TIMM1062株には、複数コピーの挿入が起こりやすい傾向がみられ、同株の形質転換効率の高さとの関連が考えられる。一方、K. lactis IFO1267株は、1コピーのみの挿入が観察された。また、図に示すように、K. marxianus IFO1735株においては、S. cerevisiae(BIO VIEW 16号参照)と同様に、形質転換体コロニーの大きさとpAUR101 のコピー数に相関がみられた。pAUR101ベクターが1コピーでもこれらの株にAureobasidin A耐性を付与できたことから、これらの株を用いた遺伝子破壊や他の分子生物学的手法に本システムが有効な手段になり得ると考えられる。
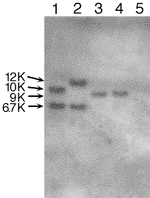
図. サザンハイブリダイゼーション(K. marxianus IFO1735の場合)
レーン
1、2:形質転換体(大コロニー)
3、4:形質転換体(小コロニー)
5:親株
表2. 形質転換体の染色体に組み込まれたpAUR101のコピー数
| 宿主株 | チェックした 形質転換体数 |
シングルコピーの 形質転換体数 |
2コピー以上の 形質転換体数 |
|---|---|---|---|
| K. marxianus IFO 1735 | 4 | 2 | 2 |
| K. lactis IFO 1267 | 4 | 4 | 0 |
| C. glabrata TIMM1062 | 7 | 1 | 6 |
| C. glabrata TIMM1064 | 4 | 2 | 2 |
