付録1. 293細胞のメンテナンス方法
293細胞は、ATCC等から購入することができます。できるかぎり継代数の少ないものを購入し、継代数の少ない段階でストックを作製して下さい。
293細胞の培養状態は、組換えアデノウイルス調製において、非常に重要なファクターであり、常に良い状態に保たねばなりません。弊社では、下記の要領で培養を行っています。
1. 細胞の戻し方
凍結細胞の入ったバイアルを液体窒素保存用タンクから取り出し、37℃の温浴中でに移します。そのまま保持し半分くらい溶けたところで取り出し余熱で最後まで融解します。新鮮な培地の入った細胞培養用フラスコまたはシャーレに、約5×104 cells/cm2程度の密度になるように戻します。密度が低すぎると戻りが悪くなります。また、高すぎてもよくありません。 37℃、5%CO2インキュベーター内で培養し、ほぼコンフルエントになったら継代します。 2. 細胞の継代
2~3日に1回程度の頻度で継代を行います。
細胞がほぼコンフルエントになったら、約1:2~1:4の割合で継代します。培地を吸引除去した後、PBS(‐)で1回洗浄します(293細胞は剥がれやすいのでご注意下さい)。PBS(‐)を吸引除去した後、0.02%EDTA-PBSを添加し(T-75フラスコで1.0 ml程度)、1~5分、室温(離れにくいときには37℃、CO2インキュベーター内)に置き、細胞を完全に剥離させます。5~10 mlの培養用培地を加え、細胞を穏やかにピペッティングすることにより完全に均一にします。必要量を、新しい培地の入った細胞培養用フラスコ、またはシャーレに加え、均一になるよう穏やかに振とうしたのち、37℃、5%CO2インキュベーター内で培養します。
3. 培養条件
本製品使用時には、293細胞を以下の条件で培養して下さい。
培養用培地: 10%FCS-DMEM
感染用培地: 5%FCS-DMEM
継代: 0.02% EDTA/PBS(‐)
培養条件:5%CO2、37℃
4. 培養時の注意点
細胞は、コンフルエントになった状態のまま放置すると傷んで状態が悪くなり、もとの状態に戻すことが困難になることがあります。継代時の密度が低すぎても増殖速度に影響があります。
また、2ヶ月以上継代培養した細胞を実験に使用することは控えて下さい。細胞の継代数が増えると、その均一性が失われ、ウイルスの感染効率が下がります。総継代数も重要です。購入時の継代数は必ずチェックするようにし、継代数が少ない段階で、ストックを作製しておかれることをお勧めします。実験に用いる細胞は、購入時の継代数+研究施設内での継代数50以下が望ましいとされています。
これらの操作は、すべて無菌的に行って下さい。また、ウイルスを使用する安全キャビネットとは別のキャビネットを使用することが理想的です。同じキャビネットを使用する場合には、ウイルス使用後、エタノール殺菌を行い、1時間以上UV照射したのち使用するようにして下さい。
5. 保存の方法
80~90% コンフルエントになったところで、細胞を剥がし、培地で1度洗浄した後、10% DMSO-90% FCS(または、市販の細胞保存液)に懸濁し、クライオチューブ(細胞保存用チューブ)に分注します。プログラムフリーザーを用いて凍結します。プログラムフリーザーがない場合には、発泡スチロールの箱などに入れて、‐80℃で一晩凍結した後、液体窒素内で保存します。チューブあたりの細胞数は、4×106cells程度とします。あまり薄い状態で保管すると、戻りが悪くなります。液体窒素に保存2~3日後、1本を戻して状態を確認するようにして下さい。
また、凍結時までの継代数を記録として残しておかれることをお勧めいたします。
6. アデノウイルスが感染した293細胞の見分け方
アデノウイルスを感染させると、ウイルス粒子は10,000個に達します。ウイルスが増殖すると、293細胞は、接着能力が低下し、丸く浮き上がって見えます(図5)。培養フラスコやシャーレの壁面を軽くタッピングすることで簡単に剥がすことができるようになります。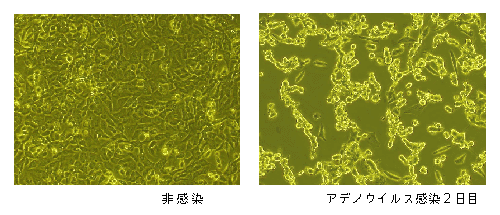
図5.293細胞
293細胞の培養状態は、組換えアデノウイルス調製において、非常に重要なファクターであり、常に良い状態に保たねばなりません。弊社では、下記の要領で培養を行っています。
1. 細胞の戻し方
凍結細胞の入ったバイアルを液体窒素保存用タンクから取り出し、37℃の温浴中でに移します。そのまま保持し半分くらい溶けたところで取り出し余熱で最後まで融解します。新鮮な培地の入った細胞培養用フラスコまたはシャーレに、約5×104 cells/cm2程度の密度になるように戻します。密度が低すぎると戻りが悪くなります。また、高すぎてもよくありません。 37℃、5%CO2インキュベーター内で培養し、ほぼコンフルエントになったら継代します。 2. 細胞の継代
2~3日に1回程度の頻度で継代を行います。
細胞がほぼコンフルエントになったら、約1:2~1:4の割合で継代します。培地を吸引除去した後、PBS(‐)で1回洗浄します(293細胞は剥がれやすいのでご注意下さい)。PBS(‐)を吸引除去した後、0.02%EDTA-PBSを添加し(T-75フラスコで1.0 ml程度)、1~5分、室温(離れにくいときには37℃、CO2インキュベーター内)に置き、細胞を完全に剥離させます。5~10 mlの培養用培地を加え、細胞を穏やかにピペッティングすることにより完全に均一にします。必要量を、新しい培地の入った細胞培養用フラスコ、またはシャーレに加え、均一になるよう穏やかに振とうしたのち、37℃、5%CO2インキュベーター内で培養します。
3. 培養条件
本製品使用時には、293細胞を以下の条件で培養して下さい。
培養用培地: 10%FCS-DMEM
| DMEM(low glucose: 1 g/l) | 500 ml |
| 非働化済みFCS | 50 ml |
| L-Glutamine | 5 ml |
| Penicillin-Streptomycin | 5 ml |
感染用培地: 5%FCS-DMEM
| DMEM(low glucose: 1 g/l) | 500 ml |
| 非働化済みFCS | 25 ml |
| L-Glutamine | 5 ml |
| Penicillin-Streptomycin | 5 ml |
継代: 0.02% EDTA/PBS(‐)
培養条件:5%CO2、37℃
4. 培養時の注意点
細胞は、コンフルエントになった状態のまま放置すると傷んで状態が悪くなり、もとの状態に戻すことが困難になることがあります。継代時の密度が低すぎても増殖速度に影響があります。
また、2ヶ月以上継代培養した細胞を実験に使用することは控えて下さい。細胞の継代数が増えると、その均一性が失われ、ウイルスの感染効率が下がります。総継代数も重要です。購入時の継代数は必ずチェックするようにし、継代数が少ない段階で、ストックを作製しておかれることをお勧めします。実験に用いる細胞は、購入時の継代数+研究施設内での継代数50以下が望ましいとされています。
これらの操作は、すべて無菌的に行って下さい。また、ウイルスを使用する安全キャビネットとは別のキャビネットを使用することが理想的です。同じキャビネットを使用する場合には、ウイルス使用後、エタノール殺菌を行い、1時間以上UV照射したのち使用するようにして下さい。
5. 保存の方法
80~90% コンフルエントになったところで、細胞を剥がし、培地で1度洗浄した後、10% DMSO-90% FCS(または、市販の細胞保存液)に懸濁し、クライオチューブ(細胞保存用チューブ)に分注します。プログラムフリーザーを用いて凍結します。プログラムフリーザーがない場合には、発泡スチロールの箱などに入れて、‐80℃で一晩凍結した後、液体窒素内で保存します。チューブあたりの細胞数は、4×106cells程度とします。あまり薄い状態で保管すると、戻りが悪くなります。液体窒素に保存2~3日後、1本を戻して状態を確認するようにして下さい。
また、凍結時までの継代数を記録として残しておかれることをお勧めいたします。
6. アデノウイルスが感染した293細胞の見分け方
アデノウイルスを感染させると、ウイルス粒子は10,000個に達します。ウイルスが増殖すると、293細胞は、接着能力が低下し、丸く浮き上がって見えます(図5)。培養フラスコやシャーレの壁面を軽くタッピングすることで簡単に剥がすことができるようになります。

図5.293細胞
