超耐熱性酵素β-glycosidaseに好適な分泌シグナルペプチドのスクリーニング
方法
Pyrococcus furiosus由来β-glycosidaseをコードするDNAをPCRで増幅しpBE-S DNAのNde I-Xba Iサイトに挿入して発現プラスミドを構築した。その後、プロトコールに従って発現プラスミドライブラリーを作製した。このプラスミドライブラリー1 μg、2 μg、4 μgをそれぞれ取扱説明書「V-1-2」に記載の方法で作製したB. subtilis RIK1285コンピテントセル300 μl、600 μl、1,200 μlに添加し、取扱説明書「V-1-3」に記載の方法で形質転換を行った。得られたコロニーのうち470個をカナマイシン(10 μg/ml)を含むLB培地1 mlに植菌し、37℃で24時間培養後、培養上清のβ-glycosidase活性を合成基質を用いて測定した。さらに発現量の異なる24クローンのプラスミドを精製し、挿入された分泌シグナルペプチドの配列を解析した。
結果
Pyrococcus furiosus由来β-glycosidaseをコードするDNAをPCRで増幅しpBE-S DNAのNde I-Xba Iサイトに挿入して発現プラスミドを構築した。その後、プロトコールに従って発現プラスミドライブラリーを作製した。このプラスミドライブラリー1 μg、2 μg、4 μgをそれぞれ取扱説明書「V-1-2」に記載の方法で作製したB. subtilis RIK1285コンピテントセル300 μl、600 μl、1,200 μlに添加し、取扱説明書「V-1-3」に記載の方法で形質転換を行った。得られたコロニーのうち470個をカナマイシン(10 μg/ml)を含むLB培地1 mlに植菌し、37℃で24時間培養後、培養上清のβ-glycosidase活性を合成基質を用いて測定した。さらに発現量の異なる24クローンのプラスミドを精製し、挿入された分泌シグナルペプチドの配列を解析した。
ランダムにピックアップした470クローンの培養上清のβ-glycosidase活性を測定したところ、様々な強さの活性を示すクローンが得られていることが確認できた。
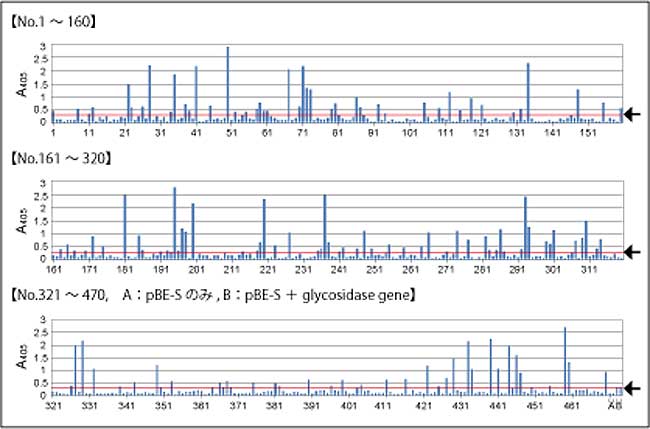
図.470クローンのβ-glycosidase活性測定結果
←:aprEシグナルペプチドでの発現レベル
さらに、様々な活性のクローンのうち24クローンについてプラスミドDNAを調製してシーケンス解析を行った。その結果、分泌シグナルペプチドとの組み合わせによって分泌発現量が異なる事がわかった。
表:挿入されていたシグナルペプチドDNA
* aspBシグナルペプチドが一部欠損した形。プライマーダイマー由来と考えられる。
このように、本製品により目的タンパク質の分泌発現に好適な分泌シグナルペプチドを選択することができた。これらの中から、さらに2次スクリーニングを行うことにより、最適なシグナルペプチドを選択することが可能である。
| コンピテントセル量 (μl) | DNA量 (μg) | コロニー数 | 形質転換効率 (colonies/μg DNA) |
| 300 | 1 | 104 | 1.0×102 |
| 600 | 2 | 244 | 1.2×102 |
| 1,200 | 4 | 497 | 1.2×102 |

図.470クローンのβ-glycosidase活性測定結果
←:aprEシグナルペプチドでの発現レベル
さらに、様々な活性のクローンのうち24クローンについてプラスミドDNAを調製してシーケンス解析を行った。その結果、分泌シグナルペプチドとの組み合わせによって分泌発現量が異なる事がわかった。
表:挿入されていたシグナルペプチドDNA
| signal peptide | クローン数 | Clone No. | |
| 活性 強 | ywsB | 7 | 28, 71, 134, 181, 200, 433, 439 |
| citH | 4 | 41, 50, 195, 459 | |
| phoB | 1 | 444 | |
| ybdG | 1 | 329 | |
| (aspB)* | 1 | 293 | |
| 活性 中 | ykwD | 2 | 45, 80 |
| ybbE | 1 | 455 | |
| ywaD | 1 | 364 | |
| abnA | 1 | 307 | |
| 活性なし | lipB | 1 | 3 |
| ybbR | 1 | 461 | |
| yopL | 1 | 120 | |
| ypbG | 1 | 320 | |
| ywmD | 1 | 383 |
このように、本製品により目的タンパク質の分泌発現に好適な分泌シグナルペプチドを選択することができた。これらの中から、さらに2次スクリーニングを行うことにより、最適なシグナルペプチドを選択することが可能である。
