EF1αプロモーターとCMV IEプロモーターの比較
◆EF1αプロモーターの特徴(文献より)
<有意性>
- CMV IEプロモーターで安定発現株が取得できないケースでもEF1αプロモーターを用いると有効な場合がある。
【参考】Nucleic Acids Res.(1999)27(24);4775-4782 など - レンチウイルスベクターで内部発現プロモーターとして用いると、細胞株によってはCMV IEプロモーターより発現が良好。
【参考】Acta Biomed.(2008)79; 192-196 - マウスES細胞で未分化/分化に関わらず発現レベルが高い(比較:CAG, CMV IE, PGK, GALV LTR, MSCV LTR promoter)。
【参考】Mol Ther.(2007)15(9); 1630-1639 - Human ES細胞ではCMV IEプロモーターを用いると安定発現株の取得が難しいが、EF1αプロモーターでは取得可能。
【参考】Mol Reprod Dev.(2009)76; 580-586
- 一過性発現では、CMV IEプロモーターやCAGプロモーターに比べ発現量が低い。
- プロモーター配列が1.2 kbと比較的長い(CMV IEプロモーター:0.6 kb)。
◆マウスES細胞での発現比較(pBApo-EF1α vs. pBApo-CMV)
I.一過性発現を顕微鏡下で比較
【方法】AcGFP1遺伝子を挿入したpBApo-EF1α NeoおよびpBApo-CMV Neoを、Xfect Stem Transfection Reagentを用いてそれぞれマウスES細胞(E14TG2a)に一過性に導入し、48時間後に位相差および蛍光顕微鏡にて観察した。
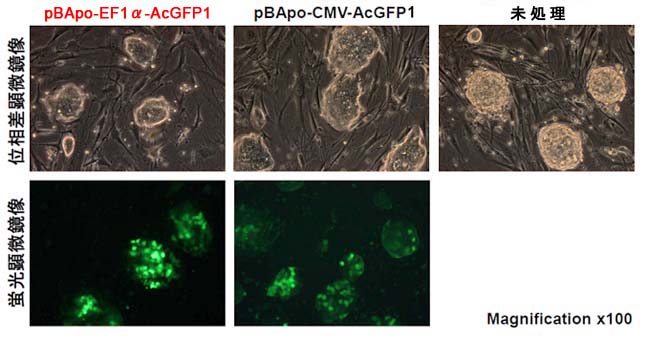
【結果】一過性発現ではCMV IEプロモーターで高発現が得られると考えられているが、本実験では、一過性発現においてもEF1αプロモーターがより高い発現を示した。なお、マウスES細胞の位相差顕微鏡像は、トランスフェクションを行った細胞と未処置細胞で差が認められず、未分化な状態を保持していると考えられる。
II.一過性発現および安定発現をFACS解析で比較
【方法】遺伝子導入から48時間後にE14TG2a細胞を回収し、Flow cytometerにてAcGFP1陽性細胞を計測した(一過性発現)。陽性細胞の割合を%positiveで示し、各陽性細胞におけるAcGFP1の発現強度をMFI(Mean of Fluorescent Intensity)で示した。
また、回収細胞を1:40に希釈継代し、G418を終濃度250 μg/mlとなるよう添加して選択培養を開始した。同様の希釈継代をさらに2回行い、増殖した細胞を薬剤耐性集団とし、Flow cytometerにて耐性細胞集団におけるAcGFP1発現を計測した(安定発現)。
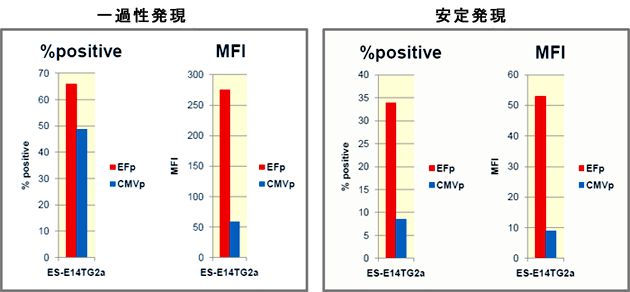
【結果】一過性発現の段階で、既にEF1αプロモーターはMFI値で4.6倍の高発現を示した。また、安定発現でもEF1αプロモーターは高い発現を示し(MFI値で5.8倍)、マウスES細胞(E14TG2a)でのEF1αプロモーターの有用性が確認できた。
【方法】AcGFP1遺伝子を挿入したpBApo-EF1α NeoおよびpBApo-CMV Neoを、Xfect Stem Transfection Reagentを用いてそれぞれマウスES細胞(E14TG2a)に一過性に導入し、48時間後に位相差および蛍光顕微鏡にて観察した。

【結果】一過性発現ではCMV IEプロモーターで高発現が得られると考えられているが、本実験では、一過性発現においてもEF1αプロモーターがより高い発現を示した。なお、マウスES細胞の位相差顕微鏡像は、トランスフェクションを行った細胞と未処置細胞で差が認められず、未分化な状態を保持していると考えられる。
II.一過性発現および安定発現をFACS解析で比較
【方法】遺伝子導入から48時間後にE14TG2a細胞を回収し、Flow cytometerにてAcGFP1陽性細胞を計測した(一過性発現)。陽性細胞の割合を%positiveで示し、各陽性細胞におけるAcGFP1の発現強度をMFI(Mean of Fluorescent Intensity)で示した。
また、回収細胞を1:40に希釈継代し、G418を終濃度250 μg/mlとなるよう添加して選択培養を開始した。同様の希釈継代をさらに2回行い、増殖した細胞を薬剤耐性集団とし、Flow cytometerにて耐性細胞集団におけるAcGFP1発現を計測した(安定発現)。

【結果】一過性発現の段階で、既にEF1αプロモーターはMFI値で4.6倍の高発現を示した。また、安定発現でもEF1αプロモーターは高い発現を示し(MFI値で5.8倍)、マウスES細胞(E14TG2a)でのEF1αプロモーターの有用性が確認できた。
◆浮遊細胞株での発現比較(pBApo-EF1α vs. pBApo-CMV)
I.一過性発現を顕微鏡下で比較
【方法】AcGFP1遺伝子を挿入したpBApo-EF1αおよびpBApo-CMVを、Xfect Transfection Reagentを用いて各細胞に一過性に導入し(血清添加培地と無添加培地で検討)、48時間後に位相差および蛍光顕微鏡を用いて観察した。(画像は血清無添加の場合)
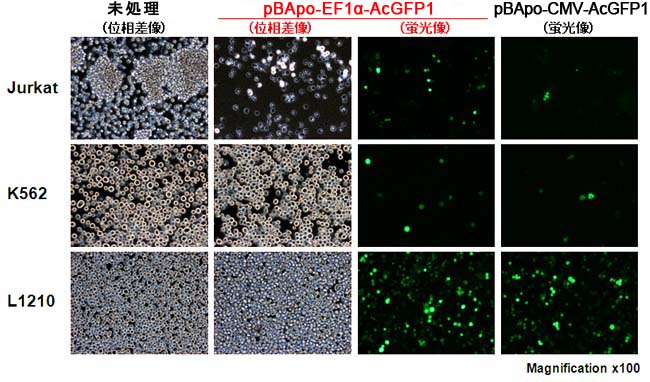
【結果】全ての細胞株でAcGFP1が検出され、EF1αプロモーター活性を確認することができた。AcGFP1陽性細胞の割合は、EF1αとCMV IEであまり差がなく、発現量も同程度だった。
II.一過性発現および安定発現をFACS解析で比較
(A)一過性発現
【方法】遺伝子導入から48時間後に細胞を回収し、Flow cytometerにてAcGFP1陽性細胞を計測した。陽性細胞の割合を%positiveで示し、各陽性細胞におけるAcGFP1の発現強度をMFI(Mean of Fluorescent Intensity)で示した。
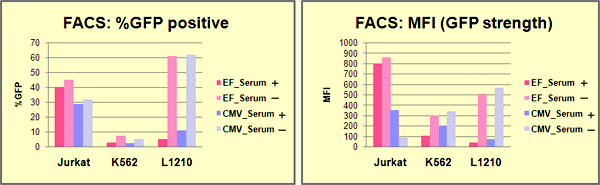
【結果】Jurkat細胞へは比較的良好に遺伝子導入を行うことができた(30~40%)。K562細胞、L1210細胞への導入効率は10%程度だったが、トランスフェクション時に培地から血清を除くことにより、L1210の導入効率を大幅に高めることができた。発現強度は細胞株により差が認められ、Jurkat細胞ではEF1αのMFI値がCMVのMFI値の2倍以上となり、プロモーター活性の指向性が認められた。
(B)安定発現
【方法】遺伝子導入から48時間後に細胞(血清無添加培地でのトランスフェクション)を回収し、1:10~20に希釈継代し、G418を終濃度1 mg/mlで添加、選択培養を開始した。耐性細胞が増殖してきたところで再度1:10~20に希釈継代し、2回の選択継代を経て増殖した細胞を薬剤耐性集団とし、各耐性細胞集団におけるAcGFP1発現をFACSにて計測した。
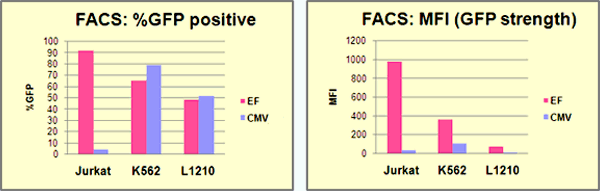
【結果】全ての細胞株で薬剤耐性細胞を取得することができた。薬剤耐性細胞においては、どの細胞株でもEF1αプロモーターがより高い活性を示した。MFI値で比較した場合、Jurkatで29.6倍、K562で3.4倍、L1210では7.7倍、EF1αは高レベルの発現を示し、特にJurkat細胞での差は顕著だった。
EF1αプロモーターはメチル化による遺伝子サイレンシングに耐性があるため安定発現株の作製に有効といわれている。今回は4週間程度の短期な培養であるため、サイレンシングの影響か否かは不明であるが、使用した3株の血球由来細胞でも優位性が確認できた。
【方法】AcGFP1遺伝子を挿入したpBApo-EF1αおよびpBApo-CMVを、Xfect Transfection Reagentを用いて各細胞に一過性に導入し(血清添加培地と無添加培地で検討)、48時間後に位相差および蛍光顕微鏡を用いて観察した。(画像は血清無添加の場合)

【結果】全ての細胞株でAcGFP1が検出され、EF1αプロモーター活性を確認することができた。AcGFP1陽性細胞の割合は、EF1αとCMV IEであまり差がなく、発現量も同程度だった。
II.一過性発現および安定発現をFACS解析で比較
(A)一過性発現
【方法】遺伝子導入から48時間後に細胞を回収し、Flow cytometerにてAcGFP1陽性細胞を計測した。陽性細胞の割合を%positiveで示し、各陽性細胞におけるAcGFP1の発現強度をMFI(Mean of Fluorescent Intensity)で示した。

【結果】Jurkat細胞へは比較的良好に遺伝子導入を行うことができた(30~40%)。K562細胞、L1210細胞への導入効率は10%程度だったが、トランスフェクション時に培地から血清を除くことにより、L1210の導入効率を大幅に高めることができた。発現強度は細胞株により差が認められ、Jurkat細胞ではEF1αのMFI値がCMVのMFI値の2倍以上となり、プロモーター活性の指向性が認められた。
(B)安定発現
【方法】遺伝子導入から48時間後に細胞(血清無添加培地でのトランスフェクション)を回収し、1:10~20に希釈継代し、G418を終濃度1 mg/mlで添加、選択培養を開始した。耐性細胞が増殖してきたところで再度1:10~20に希釈継代し、2回の選択継代を経て増殖した細胞を薬剤耐性集団とし、各耐性細胞集団におけるAcGFP1発現をFACSにて計測した。

【結果】全ての細胞株で薬剤耐性細胞を取得することができた。薬剤耐性細胞においては、どの細胞株でもEF1αプロモーターがより高い活性を示した。MFI値で比較した場合、Jurkatで29.6倍、K562で3.4倍、L1210では7.7倍、EF1αは高レベルの発現を示し、特にJurkat細胞での差は顕著だった。
EF1αプロモーターはメチル化による遺伝子サイレンシングに耐性があるため安定発現株の作製に有効といわれている。今回は4週間程度の短期な培養であるため、サイレンシングの影響か否かは不明であるが、使用した3株の血球由来細胞でも優位性が確認できた。
