操作
Human Mitochondrial DNA (mtDNA) Monitoring Primer Set(製品コード 7246)
本製品では、1種類のDNAサンプルにつき4反応(4種類のプライマーペアで反応)を行う。
まず、Primer Mix以外のマスターミックスを調製し、各々のチューブに24 μlずつ分注する。必要チューブ分のマスターミックスを調製する際は、下記<1反応あたり>の反応系を参考にする。最後に各Primer Mixを1 μlずつ分注する。この手順で反応液を調製すると、鋳型分注量の誤差によるバラツキを最小限に抑え、安定した結果を得ることができる。
<Thermal Cycler Dice Real Time System II(終売)を用いる場合>
※ Thermal Cycler Dice Real Time System II(終売)の取扱説明書に従って操作すること。
1.下記に示す反応液を氷上で調製する。
<1反応あたり>
2.下記に示す条件で反応を開始する。
<MightyAmp for Real Time (TB Green Plus)を使用する場合>
※ 使用上の注意
MightyAmp DNA Polymeraseは強力なホットスタート抗体を使用しているので、必ず98℃ 2分の初期変性を行い、抗体を熱変性させること。
<TB Green Premix Ex Taq II (Tli RNaseH Plus)を使用する場合を使用する場合>
3. 反応終了後、データの解析を行い相対定量にてコピー数を算出する。
4つのターゲットそれぞれについて得られたCt値を用いて、mtDNAのコピー数を算出する。解析に用いるmtDNAとnDNA検出用プライマーペアの組み合わせは、最適化されてるので下記の手順に従って行うこと。最終的に各プライマーの組み合わせで算出した数値の平均値としてmtDNAのコピー数を算出する。
解析には、Microsoft Office Excelで作成されたmtDNAコピー数算出用のファイル*1が利用できる。Ct値を入力することで、mtDNAコピー数を算出することができる。
反復実験の結果は、最大5個まで入力することが可能である。また、最下段には、反復実験で得られたmtDNAコピー数の平均値も算出されるので、必要に応じて利用すること。
*1 解析には、Microsoft Office Excelで作成されたmtDNAコピー数算出用のファイルが利用できます。以下からダウンロードしてご利用ください。
mtDNA_Copy_Number_Calculation (ZIP 9.0 K)
まず、Primer Mix以外のマスターミックスを調製し、各々のチューブに24 μlずつ分注する。必要チューブ分のマスターミックスを調製する際は、下記<1反応あたり>の反応系を参考にする。最後に各Primer Mixを1 μlずつ分注する。この手順で反応液を調製すると、鋳型分注量の誤差によるバラツキを最小限に抑え、安定した結果を得ることができる。
<Thermal Cycler Dice Real Time System II(終売)を用いる場合>
※ Thermal Cycler Dice Real Time System II(終売)の取扱説明書に従って操作すること。
1.下記に示す反応液を氷上で調製する。
<1反応あたり>
| 使用量 | 終濃度 | |
| MightyAmp for Real Time (TB Green Plus)(2×) またはTB Green Premix Ex Taq II (Tli RNaseH Plus)(2×) | 12.5 μl | 1× |
| Primer Mix (10 μM each) | 1 μl | 0.4 μM each |
| Genomic DNA (5 ng)* | 2 μl | |
| 滅菌精製水 | 9.5 μl | |
| Total | 25 μl |
2.下記に示す条件で反応を開始する。
<MightyAmp for Real Time (TB Green Plus)を使用する場合>
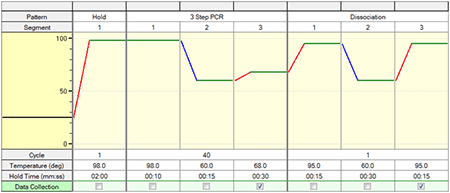 |
Hold(初期変性)
Cycle:1
3 Step PCR
98℃ 2分 Cycles:40
Dissociation98℃ 10秒 60℃ 15秒 68℃ 30秒 |
※ 使用上の注意
MightyAmp DNA Polymeraseは強力なホットスタート抗体を使用しているので、必ず98℃ 2分の初期変性を行い、抗体を熱変性させること。
<TB Green Premix Ex Taq II (Tli RNaseH Plus)を使用する場合を使用する場合>
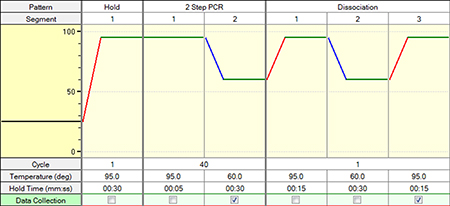 |
Hold(初期変性)
Cycle:1
2 Step PCR
95℃ 30秒 Cycles:40
Dissociation95℃ 5秒 60℃ 30秒 |
3. 反応終了後、データの解析を行い相対定量にてコピー数を算出する。
4つのターゲットそれぞれについて得られたCt値を用いて、mtDNAのコピー数を算出する。解析に用いるmtDNAとnDNA検出用プライマーペアの組み合わせは、最適化されてるので下記の手順に従って行うこと。最終的に各プライマーの組み合わせで算出した数値の平均値としてmtDNAのコピー数を算出する。
解析には、Microsoft Office Excelで作成されたmtDNAコピー数算出用のファイル*1が利用できる。Ct値を入力することで、mtDNAコピー数を算出することができる。
反復実験の結果は、最大5個まで入力することが可能である。また、最下段には、反復実験で得られたmtDNAコピー数の平均値も算出されるので、必要に応じて利用すること。
a.ND1/SLCO2B1ペアのCt値の差を求める。(ΔCt1=SLCO2B1のCt値-ND1のCt値)
b.同様にND5/SERPINA1ペアのCt値の差を求める。(ΔCt2=SERPINA1のCt値-ND5のCt値)
c.ΔCt1およびΔCt2の値から、2^N(N=ΔCt)を求める。
d.c .で得られた2つの数値の平均値をコピー数とする。
コピー数計算の一例b.同様にND5/SERPINA1ペアのCt値の差を求める。(ΔCt2=SERPINA1のCt値-ND5のCt値)
c.ΔCt1およびΔCt2の値から、2^N(N=ΔCt)を求める。
d.c .で得られた2つの数値の平均値をコピー数とする。
| Primer | Ct Value | ΔCt | 2^ΔCt | 平均コピー数 |
| ND1 | 15.75 | ΔCt1=8.78 | 440 | 574 |
| SLCO2B1 | 24.53 | |||
| ND5 | 15.04 | ΔCt2=9.47 | 709 | |
| SERPINA1 | 24.51 |
*1 解析には、Microsoft Office Excelで作成されたmtDNAコピー数算出用のファイルが利用できます。以下からダウンロードしてご利用ください。
mtDNA_Copy_Number_Calculation (ZIP 9.0 K)

NucleoSpin Tissue等で調製した高純度DNAを使用すること。
また、OD260/OD280の比を測定し、高純度であることを確認すること。