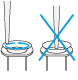
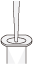ラージコンストラクトDNAのトランスフェクショングレード精製プロトコール
NucleoBond Xtra BAC(製品コード 740436.10、740436.25)
| 試薬の調製 | Buffer RES-BAC(+RNase A)*1が添付の英文説明書に従って調製、希釈されていることを確認する。 Buffer LYS-BACに沈殿が生じていないことを確認する。*2 | |||
| 1~3 | 培養液の調製 集菌 | 培養液のOD600を測定し、培養液の推奨液量を求める。 培養液の液量(V)=1,500/ OD600(ml)培養液を、4℃、4,500~6,000×gで10分間以上遠心し、上清を除去する*3。 | ||
| 4 | 菌の懸濁 | 菌体ペレットをBuffer RES-BAC(+RNase A)*1 60 mlに完全に懸濁する。 | ||
| 5 | 菌の溶解 | Buffer LYS-BAC 60 ml*2を4の菌懸濁液に加え、5回倒置撹拌する。ボルテックスはしてはならない。 室温で、5分間静置する。 5分以上放置するとベクターDNAの分解や宿主菌のゲノムDNA混入の原因となるため注意する。 | ||
| 6 | カラムの平衡化 |
| ||
| 7 | 中和 | Buffer NEU-BAC 60 mlを、5の菌溶解液に加え、直ちに、穏やかに10~15回倒置撹拌して、溶液が無色になるまで混合する。ボルテックスはしてはならない。 氷上で5分間以上静置する。 | ||
| 8 | ライセートの清澄化とローディング | 7の溶液が入ったチューブを3回反転して沈殿が均一に懸濁された状態にした後、フィルターに加える。 液を自然落下させてカラムを空にする。 | ||
| 9 | カラムの洗浄(1回目) |
| ||
| 10 | カラムフィルターの廃棄 |
| ||
| 11 | カラムの洗浄(2回目) |
| ||
| 12 | 溶出 | 65~70℃に予温したElution Buffer ELU-BAC 15 mlでDNAを溶出する。 溶出液を15 mlまたは50 ml遠心チューブ(各自で用意)に集める*4。 | ||
| 13 | イソプロパノール沈殿 | 溶出液の0.4倍(6 ml)のイソプロパノール(室温)を加え、ボルテックスで十分混合した後、室温で2分間静置する。 5,000×g以上で15分以上、室温以下(好ましくは15,000×gで30分間、4℃)で遠心する。 上清を注意深く除去する。 | ||
| 14 | DNAペレットの洗浄と乾燥 | 70%エタノール(室温)5 mlを沈殿に加え、5,000×g(好ましくは15,000×g)以上で5分間、室温で遠心する。 エタノールをチューブから完全に除去する。 10~15分間乾燥する。(乾燥しすぎるとDNAが溶解しにくくなるので注意する。) | ||
| 15 | DNAの溶解 | 500~1,000 μlのTE Bufferまたは滅菌蒸留水を加えてDNAを溶解する(収量が少ないと予想される場合は500 μl以下で溶解してもよい)。4℃、オーバーナイトで完全に溶解させることが望ましい*5。 |
| *1 | Buffer RES-BAC(+RNase A)の調製法 RNase A(凍結乾燥品)のチューブに1 mlのBuffer RES-BACを加えて完全に溶解し、全量をBuffer RES-BACのボトルに移す。 Buffer RES-BAC(+RNase A)は4℃で6ヵ月以上安定である。 |
| *2 | Buffer LYS-BACは使用前に沈殿が生じていないことを確認する。沈殿が確認された場合は30~40℃で数分間温めて撹拌し、沈殿を完全に溶解した後使用する。 |
| *3 | コピー数などにより、より多くの培養液が必要になる場合は以降のステップのRES-BAC, LYS-BAC, NEU-BACの使用量を菌体量に応じて増やす。 |
| *4 | 溶出効率を上げるために、バッファーの温度が下がらないように注意する。溶出操作中、カラムを50~60℃に加温するか、65~70℃に温めたバッファーを2~3 mlずつに分けてカラムに加えてもよい。また、溶出後、更に予温したBuffer ELU-BAC 10 mlをカラムに加えて2回目の溶出を行うと回収量を上げることができる。 |
| *5 | 長鎖DNAの切断を防ぐためピペッティングによる溶解は避ける。チューブを穏やかに振とうして溶解し、ピペッティングには広口のチップを用いる(チップの先を切断して用いることも可能)。 |
<注意>
使用時には、詳細は必ず添付の英文説明書をご確認ください。