ddPCR法を用いたAAVベクター力価測定
遺伝子治療への関心が高まる中、in vivo遺伝子治療においてはアデノ随伴ウイルス(AAV)ベクターは最も期待されているツールであり、すでに臨床にも応用されています。
AAVベクターの力価測定には一般的にqPCR法が用いられていますが、Droplet Digital PCR(ddPCR)法を用いることにより、より高精度の力価測定が可能となります。
AAVベクターの力価測定には一般的にqPCR法が用いられていますが、Droplet Digital PCR(ddPCR)法を用いることにより、より高精度の力価測定が可能となります。
ddPCR法のメリット
| ・ | 標準曲線を使用しない | → | 精度の高い測定が可能 | |
| ・ | 約20,000個に分割された液滴(droplet)で個別にPCR反応が進行するためPCR阻害物質の影響が少ない |
qPCRおよびddPCRにおける定量の仕組みとAAVサンプルにおける定量試験結果例
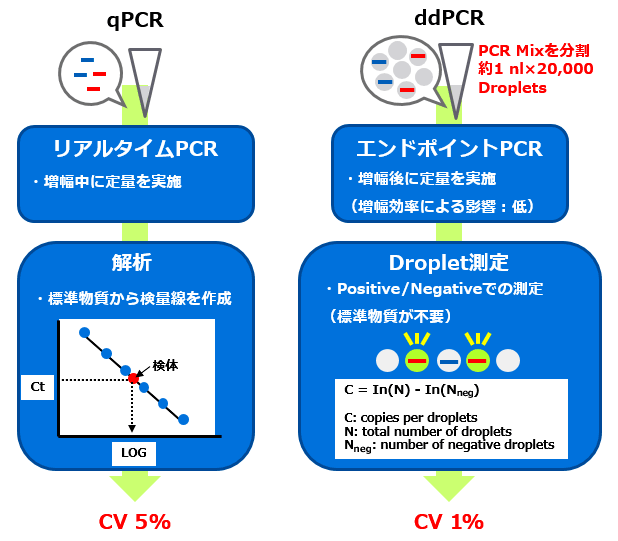
⇒ ddPCR法では、qPCR法と比較して低い変動係数であることが確認されました。
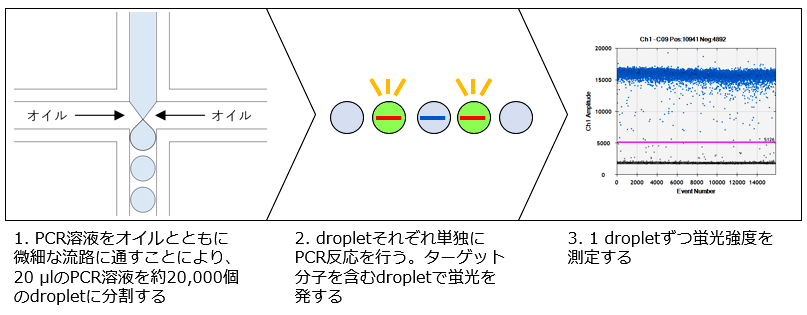
ddPCR法の原理
サービスの流れ
- ターゲットとする配列の決定およびプライマー・プローブの設計
- 予備検討:コントロール検体および人工合成プラスミドを用いてプライマー・プローブの反応性を確認いたします。
- 本試験:ご要望のグレード(簡易試験、信頼性保証、GMP)で実施いたします。GMP試験をご希望の場合は事前のバリデーションが必要となります。
ITRを用いた試験例
AAVベクターのITRをターゲットとしたプライマーおよびプローブを用いて力価を測定しました。
- 人工合成プラスミドを用いた予備検討
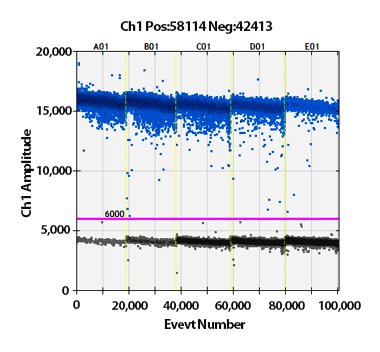
図1.各Dropletにおける蛍光強度解析結果
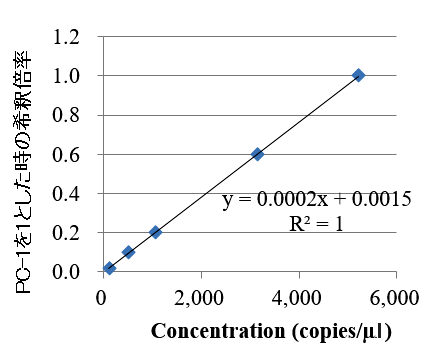
図2.人工合成プラスミドの実測値と理論値の相関性の確認結果
段階希釈した人工合成プラスミドを用いて、プライマー・プローブの反応性を確認しました。ダイナミックレンジ内で直線性が担保され、人工合成プラスミドおよびプライマー・プローブの反応性に問題がないことが確認できました。
- AAVベクター(模擬サンプル)を用いた試験
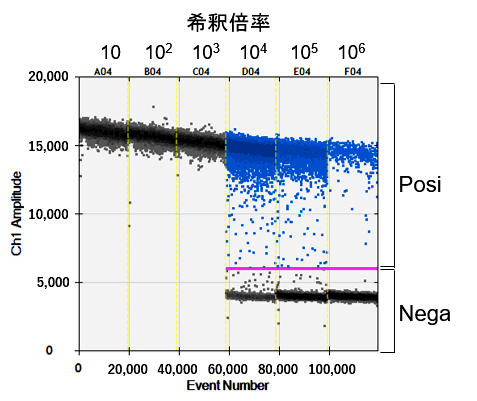
図3.各Dropletにおける蛍光強度解析
表1.解析結果

希釈倍率 コピー数
(N=3平均)(copies/µl)タイター
(N=3平均)(copies/µl)Accepted Droplets
(N=3平均)(PCR n=3)Positives per Accepted Droplets %CV
(PCR n=3)10 - - 19,283 0.00 - 102 - - 19,485 0.00 - 103 - - 19,640 0.00 - 104 2,783 5.57×109 19,866 0.91 1% 105 296 5.91×109 21,007 0.22 3% 106 29.2 5.83×109 21,202 0.02 5%
反応性に問題のないことが確認できたプライマー・プローブおよびAAVベクター(模擬サンプル)を用いて試験を実施したところ、104~106倍希釈においてCV値10%以下でタイターを特定することができました。一方、ダイナミックレンジから大きく外れる希釈倍率ではデータ取得ができない結果となっており、サンプルを最適なコピー数に希釈することが、正しい結果取得に重要です。
関連製品・受託
残留不純物試験、純度・同一性試験
試験法開発・技術移管およびバリデーション
