ノロウイルス遺伝子型判別用PCRキット Ver.2による実検体由来精製RNAを用いた検出確認試験
ノロウイルス遺伝子型判別用PCRキットVer.2(以下、本製品:製品コード RC122A/RC123A)*1を用いて、実検体より精製されたRNAを供し、検出確認試験を行いました。比較として、病原体検出マニュアル*2を一部改変した反応系(以下、標準法)による試験も行いました。試薬組成、PCR条件、試験結果を以下に示します。また、本試験にて増幅不良となった検体については、さらに追加試験を行いました。
遺伝子型既知の検体(便乳剤)より、NucleoSpin Virus(製品コード 740983.10/.50/.250)を用いてRNAを抽出し、TaKaRaノロウイルスGI/GII検出キット(1液タイプ)Ver.2(製品コード RR204A)により各検体のCt値を求めました。
<試薬組成・PCR条件>
上記で求めたCt値を参照して高~低コピーの21検体を任意に選定し、本製品による試験に供しました。
(選定した検体のCt値は、ノロウイルス・GI(以下、GI)の検出において、19.6≦Ct≦35.3、ノロウイルス・GII(以下、GII)の検出において19.1≦Ct≦37.7でした。)
標準法は、One step RT-PCR法として実施しました。
PCR産物の電気泳動にはTAE bufferと3%アガロースゲルを使用し、PCR産物5 μlを供して、100 V/25分間の泳動を行いました(図1、2、3)。
(PCR条件)
(PCR条件)
<GI>
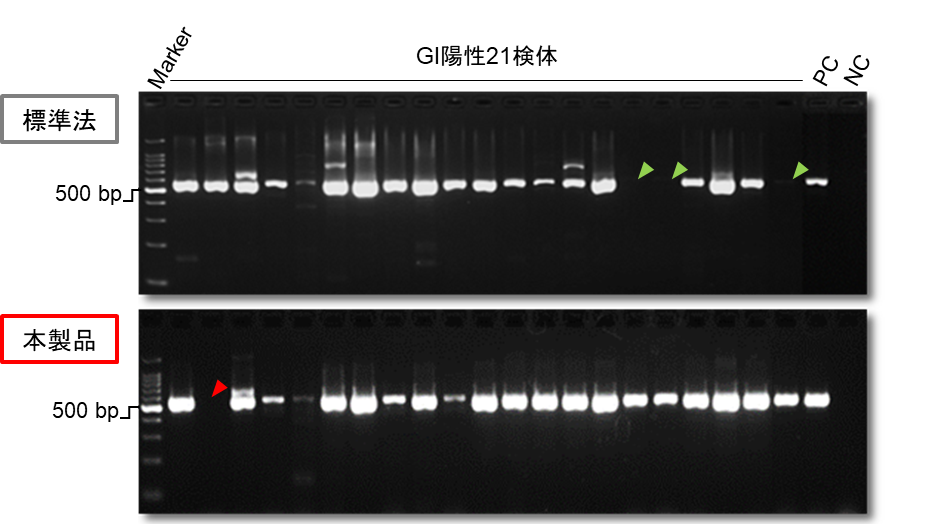
標準法では21検体中18検体(85.7%)、本製品では21検体中20検体(95.2%)で、増幅産物を用いた配列解析が可能でした(図1)。
<GII>
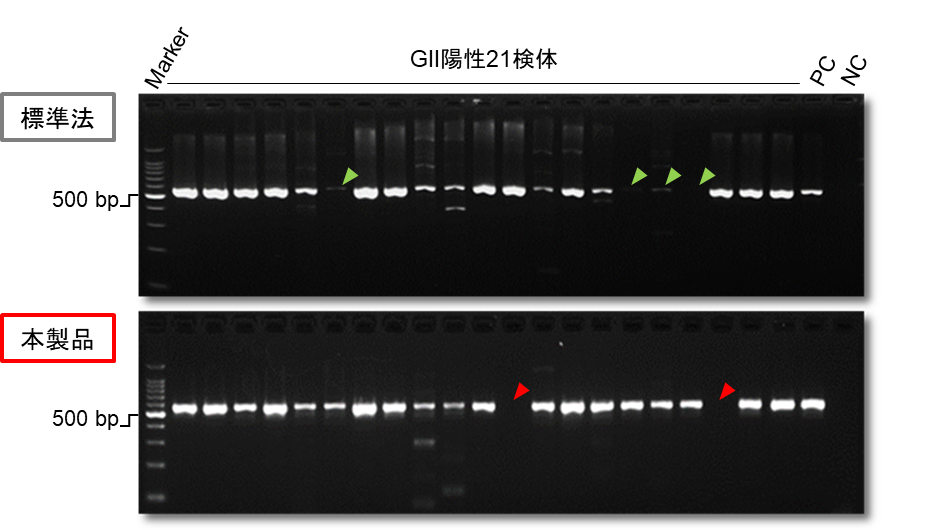
標準法では21検体中17検体(81.0%)、本製品では21検体中19検体(90.5%)で、増幅産物を用いた配列解析が可能でした(図2)。
得られた精製RNAのCt値・遺伝子型および電気泳動での検出可否を下記に示します(表1)。
表中の数値はCt値です。またCt>30を太字で示しています。
<表1.得られた精製RNAの遺伝子型およびCt値と検出可否の一覧>
本製品にて増幅不良となった検体(表中×)は、いずれもCt<30であり、また特定の遺伝子型によるものでもありませんでした。
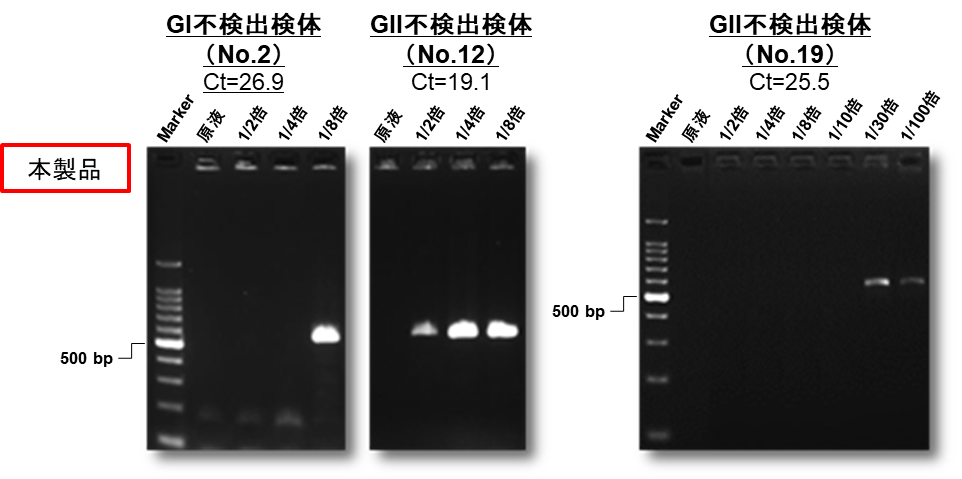
2~8倍までの鋳型希釈により、2検体で目的産物の増幅が認められました(検体 No.2、No.12)。一方で、検体によっては、~100倍程度の鋳型希釈が有効であることも確認されました(検体 No.19)。
第43回 日本食品微生物学会学術総会 発表資料より
(タカラバイオ比較データ)
*1 Norovirus (GI) RT-PCR Kit for genotyping Ver.2(製品コード RC122A)、Norovirus (GII) RT-PCR Kit for genotyping Ver.2(製品コード RC123A)
*2 国立感染症研究所「病原体検出マニュアルノロウイルス(第1版)(令和元年6月)」
*3 病原体検出マニュアル掲載のプライマー GI: MON432, GII: MON431
*4 病原体検出マニュアル掲載のプライマー GI: G1-SKR, GII: G2-SKR
【方法】
<鋳型RNAの調製>遺伝子型既知の検体(便乳剤)より、NucleoSpin Virus(製品コード 740983.10/.50/.250)を用いてRNAを抽出し、TaKaRaノロウイルスGI/GII検出キット(1液タイプ)Ver.2(製品コード RR204A)により各検体のCt値を求めました。
<試薬組成・PCR条件>
上記で求めたCt値を参照して高~低コピーの21検体を任意に選定し、本製品による試験に供しました。
(選定した検体のCt値は、ノロウイルス・GI(以下、GI)の検出において、19.6≦Ct≦35.3、ノロウイルス・GII(以下、GII)の検出において19.1≦Ct≦37.7でした。)
標準法は、One step RT-PCR法として実施しました。
PCR産物の電気泳動にはTAE bufferと3%アガロースゲルを使用し、PCR産物5 μlを供して、100 V/25分間の泳動を行いました(図1、2、3)。
本製品(製品コード RC122A/RC123A)
| RT-PCR Mix (NV)-2 | 25 μl |
| Enzyme Mix (NV) | 4 μl |
| GI or GII Primer Mix (NV)-2 | 2 μl |
| 滅菌水 | 17 μl |
| 精製RNA (Template) | 2 μl |
| Total | 50 μl |
(PCR条件)
| 42℃ | 20分 | ||
| 94℃ | 1分 | ||
| 98℃ | 10秒 | 45サイクル | |
| 52℃ | 15秒 | ||
| 68℃ | 30秒 |
標準法
| 2×PCR Buffer for KOD -Multi & Epi- | 25 μl |
| KOD-Multi & Epi- | 1 μl |
| M-MLV Reverse Transcriptase(200 U/μl)- | 0.2 μl |
| Forward primer(10 μM)*3 | 2.5 μl |
| Reverse primer(10 μM)*4 | 2.5 μl |
| 滅菌水 | 16.8 μl |
| 精製RNA (Template) | 2 μl |
| Total | 50 μl |
(PCR条件)
| 42℃ | 20分 | ||
| 94℃ | 2分 | ||
| 98℃ | 10秒 | 45サイクル | |
| 50℃ | 15秒 | ||
| 68℃ | 30秒 |
【結果】
本製品により得られたPCR産物の電気泳動について、以下のとおり示します。<GI>
標準法では21検体中18検体(85.7%)、本製品では21検体中20検体(95.2%)で、増幅産物を用いた配列解析が可能でした(図1)。

図1. PCR産物(GI)の電気泳動写真
矢印は増幅不良により、配列解析不可となった検体を示す。
Marker: 100 bp ladder GI目的産物鎖長: 579 bp
矢印は増幅不良により、配列解析不可となった検体を示す。
Marker: 100 bp ladder GI目的産物鎖長: 579 bp
<GII>
標準法では21検体中17検体(81.0%)、本製品では21検体中19検体(90.5%)で、増幅産物を用いた配列解析が可能でした(図2)。

図2. PCR産物(GII)の電気泳動写真
矢印は増幅不良により、配列解析不可となった検体を示す。
Marker: 100 bp ladder GII目的産物鎖長: 570 bp
矢印は増幅不良により、配列解析不可となった検体を示す。
Marker: 100 bp ladder GII目的産物鎖長: 570 bp
得られた精製RNAのCt値・遺伝子型および電気泳動での検出可否を下記に示します(表1)。
表中の数値はCt値です。またCt>30を太字で示しています。
<表1.得られた精製RNAの遺伝子型およびCt値と検出可否の一覧>
| No. | 既知の 遺伝子型 | Ct値 (精製RNA) | 本製品 | 標準法 |
|---|---|---|---|---|
| 1 | GI.2[P2] | 32.0 | 〇 | 〇 |
| 2 | GI.3[P3] | 26.9 | × | 〇 |
| 3 | GI.3[P3] | 30.2 | 〇 | 〇 |
| 4 | GI.3[P3] | 27.8 | 〇 | 〇 |
| 5 | GI.4[P4] | 33.7 | 〇 | 〇 |
| 6 | GI.4[P4] | 28.7 | 〇 | 〇 |
| 7 | GI.4[P4] | 24.8 | 〇 | 〇 |
| 8 | GI.6[PNA4] | 34.3 | 〇 | 〇 |
| 9 | GI.6[PNA4] | 19.6 | 〇 | 〇 |
| 10 | GI.6[PNA4] | 35.3 | 〇 | 〇 |
| 11 | GI.7[P7] | 28.5 | 〇 | 〇 |
| 12 | GI.7[P7] | 32.0 | 〇 | 〇 |
| 13 | GI.7[P7] | 28.1 | 〇 | 〇 |
| 14 | GI.7[P7] | 31.5 | 〇 | 〇 |
| 15 | GI.7[P7] | 25.8 | 〇 | 〇 |
| 16 | GI.7[P7] | 29.1 | 〇 | × |
| 17 | GI.7[P7] | 29.7 | 〇 | × |
| 18 | GI.7[P7] | 33.1 | 〇 | 〇 |
| 19 | GI.7[P7] | 23.4 | 〇 | 〇 |
| 20 | GI.7[P7] | 30.3 | 〇 | 〇 |
| 21 | GI.7[P7] | 33.5 | 〇 | × |
| No. | 既知の 遺伝子型 | Ct値 (精製RNA) | 本製品 | 標準法 |
|---|---|---|---|---|
| 1 | GII.2[P16] | 29.2 | 〇 | 〇 |
| 2 | GII.2[P16] | 37.7 | 〇 | 〇 |
| 3 | GII.3[P3] | 22.3 | 〇 | 〇 |
| 4 | (GII.3[P12]) | 21.8 | 〇 | 〇 |
| 5 | GII.3[P12] | 28.3 | 〇 | 〇 |
| 6 | GII.3[P29] | 27.5 | 〇 | × |
| 7 | GII.4[P4] | 23.6 | 〇 | 〇 |
| 8 | GII.4[P16] | Ct>30 | 〇 | 〇 |
| 9 | GII.4[P1] | 26.4 | 〇 | 〇 |
| 10 | GII.4[P31] | 20.5 | 〇 | 〇 |
| 11 | GII.5[P5] | 26.2 | 〇 | 〇 |
| 12 | GII.6[P6] | 19.1 | × | 〇 |
| 13 | GII.6[P7] | 23.7 | 〇 | 〇 |
| 14 | GII.6[P7] | 19.5 | 〇 | 〇 |
| 15 | GII.6[P7] | 24.4 | 〇 | 〇 |
| 16 | GII.6[P7] | 25.1 | 〇 | × |
| 17 | GII.6 | 27.4 | 〇 | × |
| 18 | GII.6 | 25.7 | 〇 | × |
| 19 | GII.10[P12] | 25.5 | × | 〇 |
| 20 | GII.12[PNA7] | 25.7 | 〇 | 〇 |
| 21 | GII.17[P17] | 24.4 | 〇 | 〇 |
本製品にて増幅不良となった検体(表中×)は、いずれもCt<30であり、また特定の遺伝子型によるものでもありませんでした。
【増幅不良となった検体の追加検討】
本製品にて増幅不良となったGI 1検体とGII 2検体について、それぞれの精製RNAを滅菌水により2~100倍まで希釈し、本製品に再度供しました。その後、PCR産物5 μlを電気泳動に供しました(図3)。
図3. 希釈精製RNAを用いたPCR産物の電気泳動写真
Ctは各検体の精製RNA原液のCt値を示す。
Maker:100 bp ladder GI目的産物鎖長: 579 bp GII目的産物鎖長: 570 bp
Ctは各検体の精製RNA原液のCt値を示す。
Maker:100 bp ladder GI目的産物鎖長: 579 bp GII目的産物鎖長: 570 bp
2~8倍までの鋳型希釈により、2検体で目的産物の増幅が認められました(検体 No.2、No.12)。一方で、検体によっては、~100倍程度の鋳型希釈が有効であることも確認されました(検体 No.19)。
【まとめ】
本製品では、実検体由来の精製RNAを供した場合にも、90%以上の検出率を示しました。増幅不良となった検体は、滅菌水により適宜希釈することで、検出可能となりました。第43回 日本食品微生物学会学術総会 発表資料より
(タカラバイオ比較データ)
*1 Norovirus (GI) RT-PCR Kit for genotyping Ver.2(製品コード RC122A)、Norovirus (GII) RT-PCR Kit for genotyping Ver.2(製品コード RC123A)
*2 国立感染症研究所「病原体検出マニュアルノロウイルス(第1版)(令和元年6月)」
*3 病原体検出マニュアル掲載のプライマー GI: MON432, GII: MON431
*4 病原体検出マニュアル掲載のプライマー GI: G1-SKR, GII: G2-SKR
