Poly(A)配列後の残余塩基がIVT合成mRNAの細胞内タンパク発現に与える影響
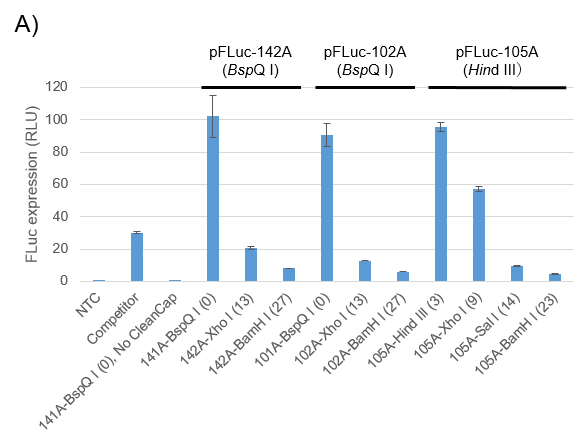
A.鋳型プラスミドの線状化のデザインがIVT合成mRNAの細胞内タンパク質発現に与える影響
<方法>
Firefly Luciferase (FLuc) mRNAをコードする3種類の鋳型プラスミド[pFLuc-142A (BspQ I), pFLuc-102A (BspQ I), pFLuc-105A (Hind III)]*1を、それらPoly(A)配列後にある様々な制限酵素サイトで切断し、CleanCapを用いたin vitro transcription (IVT) の合成鋳型とした*2。得られたmRNAの各0.5 μgをTransIT-mRNA Transfection Kit(製品コード MIR2225/MIR2250/MIR2255/MIR2256)を用いてHEK293T細胞にトランスフェクションし、24時間後のFLuc活性を測定しました。
*1 3種類のプラスミド配列は、Poly(A)配列長およびPoly(A)配列後の制限酵素サイト以外は同じです。
*2 各サンプル名は、各mRNAのPoly(A)配列長、線状化に使用された制限酵素、およびPoly(A)配列後の余剰塩基数(括弧内)を表しています。
<結果>
いずれのプラスミドにおいてもPoly(A)配列後の余剰塩基数が増加するにつれ、FLucタンパク質の発現が大きく低下した。このことは、鋳型プラスミドの線状化のデザインが目的タンパク質の細胞内発現に大きな影響をもつことを示しています。
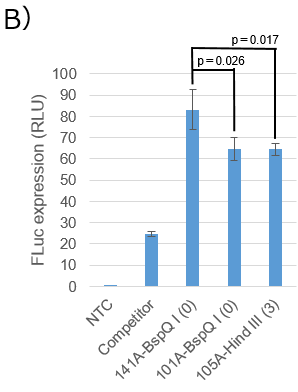
B. mRNAのPoly(A)配列長増加による細胞内タンパク質発現の増加
<方法>
Poly(A)配列長の増加(約40塩基)とPoly(A)配列後の余剰3塩基の影響について、FLucのタンパク質発現に有意差が見られるのか、Aと同様の実験をn=4で行いました。
<結果>
FLuc mRNAのPoly(A)配列長を40塩基増加させた場合、タンパク質発現が有意に高くなりました[141A-BspQ I (0) vs. 101A-BspQ I (0); 28.5%増(p=0.026)、141A-BspQ I (0) vs. 105A-Hind III (3); 28.9%増(p=0.017)]。このことから、Linearized Template Vector (BspQ I)を用いて構築したプラスミド鋳型からは、Linearized Template Vector(製品コード 6143)を使用した場合と比べ、より高発現の目的mRNAが調製できると考えられます。
一方、Poly(A)配列長がほぼ同じである101A-BspQ I (0)と105A-Hind III (3)に関しては、FLucタンパク質の発現に違いはほぼ見られませんでした(p=0.959)。従って、3塩基程度の余剰塩基であれば、タンパク質発現にはほとんど影響が無いことが再確認されました。
