mRNAを用いて作製したCAR-T細胞の細胞傷害活性評価
CAR(キメラ抗原受容体)遺伝子治療は、細胞表面に発現しているがん抗原を特異的に認識するCAR遺伝子を、患者由来のリンパ球(T細胞)に導入し、再び生体内へ輸注するがん治療法です。
CAR遺伝子の導入には通常、恒常的な発現を期待してゲノムへ挿入されるウイルスベクターを使用しますが、複数候補のCAR遺伝子の機能評価を行うようなケースでは、複数種類のウイルスベクターを準備する必要があり、探索の初期段階においては煩雑な作業となるケースがあります。今回、in vitro transcription(IVT)にて作製したCAR mRNAをT細胞に導入することで、一過的にCAR-T細胞を作製し(mRNA CAR-T細胞)、その機能評価を実施した事例を紹介します。mRNA導入には、米国MaxCyte社が開発したエレクトロポレーション装置『ExPERTシステム』を使用しました。

タカラバイオでは、ラボレベルでの高収量mRNA作製に適した一連の試薬群を取り揃えています。より大スケールでのmRNA製造が必要なお客様向けには、受託製造・品質試験サービスも展開しています。また、MaxCyte ATxエレクトロポレーターを用いた細胞加工サービス(遺伝子導入細胞作製、ゲノム編集細胞作製など)にも対応していますので、お気軽にご相談ください。
CAR遺伝子の導入には通常、恒常的な発現を期待してゲノムへ挿入されるウイルスベクターを使用しますが、複数候補のCAR遺伝子の機能評価を行うようなケースでは、複数種類のウイルスベクターを準備する必要があり、探索の初期段階においては煩雑な作業となるケースがあります。今回、in vitro transcription(IVT)にて作製したCAR mRNAをT細胞に導入することで、一過的にCAR-T細胞を作製し(mRNA CAR-T細胞)、その機能評価を実施した事例を紹介します。mRNA導入には、米国MaxCyte社が開発したエレクトロポレーション装置『ExPERTシステム』を使用しました。

タカラバイオでは、ラボレベルでの高収量mRNA作製に適した一連の試薬群を取り揃えています。より大スケールでのmRNA製造が必要なお客様向けには、受託製造・品質試験サービスも展開しています。また、MaxCyte ATxエレクトロポレーターを用いた細胞加工サービス(遺伝子導入細胞作製、ゲノム編集細胞作製など)にも対応していますので、お気軽にご相談ください。
【実験結果】
- CAR陽性率の経時的変化
MaxCyte ATxを用いてT細胞*1に抗CD19 CAR mRNA*2を導入し、導入後3時間から96時間までのCAR陽性率を測定した。その結果、導入3時間後からCARの高発現が認められ、導入24時間後の陽性率はおよそ90%に達した。その後、CAR発現は経時的に減衰し、96時間後にはほぼ消失した(図1A)。また、エレクトロポレーション後の細胞増殖率はmRNA非導入群と同程度であった(図1B)。
*1 レトロネクチン法で誘導後、10日間拡大培養し調製した。T細胞純度は約90%であった。
*2 Takara IVTpro mRNA Synthesis Systemを用いて調製した。Capping反応にはCleanCap Reagent AG(TriLink社)を使用した。
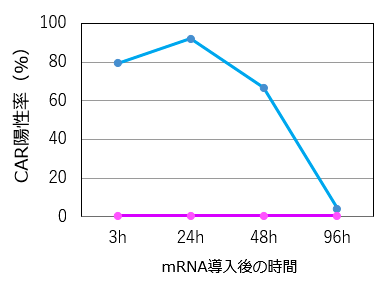
図1A. CAR陽性率の経時的変化
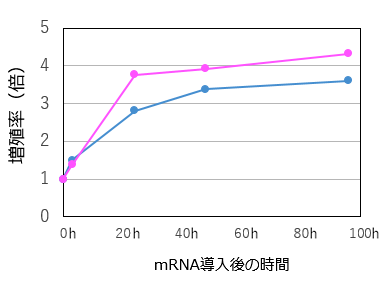
図1B. 導入後の増殖率
mRNA導入
ネガティブコントロール
(エレクトロポレーションのみ) - 細胞傷害活性の測定
抗CD19 CAR mRNAを導入した翌日に、mRNA CAR-T細胞をCD19陽性NALM-6細胞(急性リンパ性白血病由来)と共培養し、細胞傷害活性を測定した(図2A)。その結果、mRNA CAR-T細胞はレンチウイルスを用いて作製したCAR-T細胞*3と同程度の細胞傷害活性を示した(図2B)。
*3 レンチウイルス(LVpro Packaging Mix使用)を用いてCAR遺伝子を導入。CAR陽性率は約90%であった。
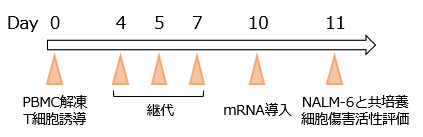
図2A. 実験スケジュール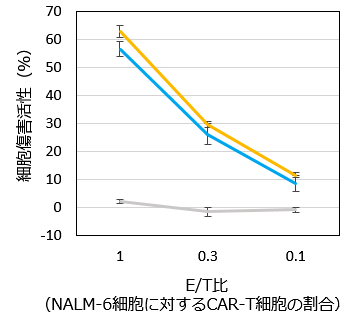
図2B. 細胞傷害活性
mRNA CAR-T
レンチウイルスCAR-T
ネガティブコントロール
(エレクトロポレーションのみ)
