Thermal Cycler Dice® Real Time System シリーズを用いる場合の操作方法
TB Green® Premix Ex Taq™ II FAST qPCR(製品コード RR830A/B)
Perfect Real Time サポートシステム(PRTSS)のプライマーを使用する場合
- 下記に示すPCR反応液を調製する。
<1反応あたり>
試薬 使用量 最終濃度 TB Green Premix Ex Taq II Fast qPCR (2X) 12.5 μl 1× PCR Forward Primer(10 μM) 1 μl 0.4 μM*1 PCR Reverse Primer(10 μM) 1 μl 0.4 μM*1 template(<100 ng)*2 ≦ 2.5 μl 滅菌精製水 x μl Total 25 μl *3 *1 最終プライマー濃度は0.4 μMで良い結果が得られる場合が多いですが、反応性に問題があるときは0.2~1.0 μMの範囲で最適な濃度をご検討ください。*2 DNA template の場合は、100 ng以下を用いることを推奨します。cDNA template(RT反応液)の場合は、添加量をPCR反応液容量の10%以下にしてください。*3 反応液量は25 μlを推奨。 - 反応を開始する。
PCR反応は、下記のシャトルPCR標準プロトコールで行うことをお勧めします。まずはこのプロトコールを試し、必要に応じてPCR条件を至適化してください。
※ 自作のプライマーなどPRTSS以外のプライマーの場合でTm値が低めのプライマーなど、シャトルPCRでの反応が難しい場合には、3ステップPCRを行います。
シャトルPCR標準プロトコール
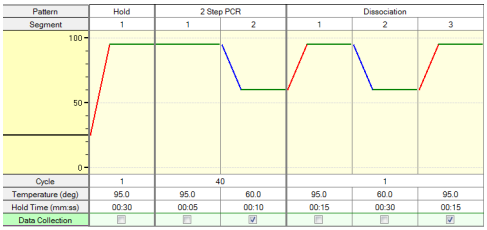 Hold(初期変性)*4
Hold(初期変性)*4
Cycle:1
95℃、30秒2 Step PCR*5
Dissociation
Cycles:40
95℃、5秒
60℃、10秒
*4 PCR産物(dUTPを含む)によるコンタミネーションが疑われる場合には、初期変性の前に25℃ 2~10分のステップを実施してください。UNGの作用により前回の実験からキャリーオーバーしたPCR産物が分解されます。*5 PCR条件を至適化する場合は、「実験条件の選び方」をご確認ください。
※使用上の注意
本製品に使用している変異型Taq HSはポリメラーゼ活性を抑制する抗Taq抗体を利用したホットスタートPCR用酵素です。他社の化学修飾タイプのホットスタートPCR酵素で必要なPCR反応前の95℃(5~)15分の活性化ステップは行わないでください。必要以上の熱処理を加えると酵素活性が低下し、増幅効率、定量精度に影響を及ぼす傾向があります。PCR反応前に鋳型の初期変性を行う場合でも、通常95℃ 30秒で充分です。 - 反応終了後、増幅曲線と融解曲線を確認し、定量を行う場合は検量線を作成する。
解析方法は、リアルタイムPCR装置の取扱説明書を参照してください。
