実験条件の選び方
TB Green™ Premix Ex Taq™ II FAST qPCR(製品コード RR830A/B)
推奨条件(シャトルPCR標準プロトコール)で良好な反応性が得られない場合には、下記の要領でプライマー濃度やPCR条件の検討を行う。また、反応系によっては、特性が異なる他のTB Green PremixシリーズリアルタイムPCR試薬(製品コード RR820A/B、RR420S/A/B、RR091A/B)を用いることにより、反応性が大きく改善することもある。
実験条件を選ぶ際には、反応特異性と増幅効率の両方を考慮して総合的に判断する。両方のバランスが取れた実験系では広い濃度範囲で正確な定量が可能である。
○ 反応特異性が高い実験系
【プライマー濃度の検討】
【PCR条件の検討】
実験条件を選ぶ際には、反応特異性と増幅効率の両方を考慮して総合的に判断する。両方のバランスが取れた実験系では広い濃度範囲で正確な定量が可能である。
○ 反応特異性が高い実験系
- No Template Controlでプライマーダイマーなどの非特異的増幅が生じない。
- 目的産物以外の非特異的増幅が生じない。
- 増幅産物がより早いサイクルで検出される(Ct値が小さい)。
- PCR増幅効率が高い(理論値である100%に近い)。
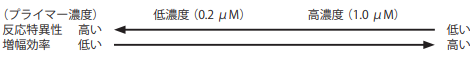
【プライマー濃度の検討】
プライマー濃度と反応特異性および増幅効率の間には、以下のような関係がある。反応特異性を上げるにはプライマー濃度を下げ、
増幅効率を上げるにはプライマー濃度を上げる。
【PCR条件の検討】
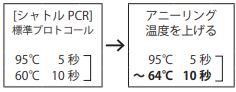
- ○ 反応特異性を上げるには
アニーリング温度を上げると反応特異性が改善することがある。増幅効率とのバランスを確認しながら、検討を行う。
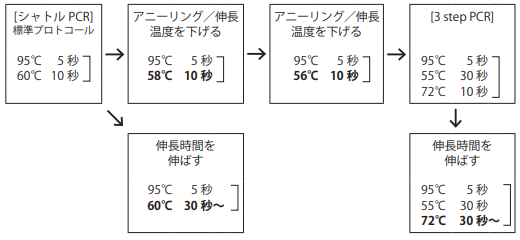
- ○ 増幅効率を上げるには
1)アニーリング温度/伸長温度を下げるか、3 step PCRに変更、または伸長時間時間を伸ばすことにより、増幅効率が改善することがある。以下の手順で検討を行う。
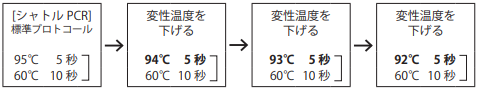
2)変性温度を95℃から1℃ずつ92℃まで下げることにより、増幅効率が改善することがあります。
- ○ 初期変性について
初期変性は通常95℃、30秒で充分である。環状プラスミドやゲノムDNAなど変性しにくい鋳型でも、ほとんどの場合、この条件で良好に反応できる。鋳型の状態によっては、95℃、1~2分程度に延長することが可能であるが、時間が長すぎると酵素の失活を招く恐れがあるので、2分以上の条件は推奨しない。
