Standard Protocol
(Premix WST-1 Cell Proliferation Assay System)
A. 必要な器具
・インキュベーター(37℃)
・遠心機
・420-480nmの波長に対応するフィルターをもつマイクロプレートリーダー(対照波長600nm以上のフィルターが望ましい)
・顕微鏡
・血球計算盤
・マルチチャンネルピペッター(10、50、100μl)
・滅菌済ピペットチップ
・96ウェルプレート(細胞培養用、平底)
B. 操作手順
1. 加湿、常圧下(例えば、37℃、5%CO2 )で、最終的な培地の液量が100μl/wellになるように、96ウェルプレートで細胞を培養する*。
* 培養時間や培養細胞濃度は、個々の実験条件や用いている細胞系による。ほとんどの実験では細胞濃度は0.1~5×104個/well、培養時間は24~96時間が適当である。
2. 細胞培養終了後、Premix WST-1を1 wellあたり10μlずつ加える。
3. 加湿、常圧下(例えば、37℃、5%CO2 )で0.5~4時間インキュベートする。
4. マイクロプレートリーダーを用いて、バックグランドコントロール( 「C」参照 )に対するサンプルの吸光度を測定する。ホルマザン産物の吸光度を測定するための波長は、マイクロプレートリーダーの利用できるフィルター によるが、420-480nmの間である(最大吸光は約440nm)(図1)。対照波長は600nm以上がよい。
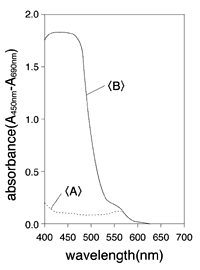
図1:Premix WST-1 Cell Proliferation Assey Systenの吸収曲線<A>とミトコンドリア脱水素酵素活性による分解反応産物(formazan)の吸収曲線
Premix WST-1 Cell Proliferation Assey Systenは、10%FCSを含むRPMI1640(共にBioWittaker社)の細胞懸濁水に1:10で希釈した。
C. バックグランドコントロール(ブランク)
1つのwellに「B-1」で用いた培地100 μlとPremix WST-1を10μl加える。これをマイクロプレートリーダーのブランクポジションで、バックグランドコントロール(細胞のない培地+Premix WST-1の吸光度)として用いる。細胞のない培地にPremix WST-1を加えた場合でも、わずかな自発的の吸光度がある。このバックグランドの吸光度は、培地、インキュベーション時間、光への露出による。2時間後の典型的なバックグランドの吸光度は0.1~0.2の間である。
<使用上の注意>
・Premix WST-1添加後の至適インキュベーション時間は、個々の実験により異なる(例えば、用いている細胞の種類や濃度など)。従って、実験においてはPremix WST-1を添加後、異なった時間(例えば、0.5、1、2、4時間)で繰り返し吸光度を測定することにより最適のインキュベーション時間を決める。
・高い感度を得たい場合は、Premix WST-1存在下で細胞をより長い時間インキュベーションするとよい。
プロトコール早見表
・インキュベーター(37℃)
・遠心機
・420-480nmの波長に対応するフィルターをもつマイクロプレートリーダー(対照波長600nm以上のフィルターが望ましい)
・顕微鏡
・血球計算盤
・マルチチャンネルピペッター(10、50、100μl)
・滅菌済ピペットチップ
・96ウェルプレート(細胞培養用、平底)
B. 操作手順
1. 加湿、常圧下(例えば、37℃、5%CO2 )で、最終的な培地の液量が100μl/wellになるように、96ウェルプレートで細胞を培養する*。
* 培養時間や培養細胞濃度は、個々の実験条件や用いている細胞系による。ほとんどの実験では細胞濃度は0.1~5×104個/well、培養時間は24~96時間が適当である。
2. 細胞培養終了後、Premix WST-1を1 wellあたり10μlずつ加える。
3. 加湿、常圧下(例えば、37℃、5%CO2 )で0.5~4時間インキュベートする。
4. マイクロプレートリーダーを用いて、バックグランドコントロール( 「C」参照 )に対するサンプルの吸光度を測定する。ホルマザン産物の吸光度を測定するための波長は、マイクロプレートリーダーの利用できるフィルター によるが、420-480nmの間である(最大吸光は約440nm)(図1)。対照波長は600nm以上がよい。

図1:Premix WST-1 Cell Proliferation Assey Systenの吸収曲線<A>とミトコンドリア脱水素酵素活性による分解反応産物(formazan)の吸収曲線
Premix WST-1 Cell Proliferation Assey Systenは、10%FCSを含むRPMI1640(共にBioWittaker社)の細胞懸濁水に1:10で希釈した。
C. バックグランドコントロール(ブランク)
1つのwellに「B-1」で用いた培地100 μlとPremix WST-1を10μl加える。これをマイクロプレートリーダーのブランクポジションで、バックグランドコントロール(細胞のない培地+Premix WST-1の吸光度)として用いる。細胞のない培地にPremix WST-1を加えた場合でも、わずかな自発的の吸光度がある。このバックグランドの吸光度は、培地、インキュベーション時間、光への露出による。2時間後の典型的なバックグランドの吸光度は0.1~0.2の間である。
<使用上の注意>
・Premix WST-1添加後の至適インキュベーション時間は、個々の実験により異なる(例えば、用いている細胞の種類や濃度など)。従って、実験においてはPremix WST-1を添加後、異なった時間(例えば、0.5、1、2、4時間)で繰り返し吸光度を測定することにより最適のインキュベーション時間を決める。
・高い感度を得たい場合は、Premix WST-1存在下で細胞をより長い時間インキュベーションするとよい。
プロトコール早見表
| Step | 手順 | 培養量 | 時間 |
| 1 | 96ウェルプレートで細胞培養を行う。 | 100μl/well、0.1~5 × 104cells/well | 24~96hr |
| 2 | Premix WST-1を加えて、37℃、加湿、常圧下でインキュベーションする。 | 10μl/well | 0.5~4hr |
| 3 | 対照波長600nm以上で、420-480nmでマイクロプレートリーダーを用いて吸光度を測定する。 |
