TaKaRa RNA LA PCR™ Kit (AMV) Ver.1.1
Standard Protocol
(TaKaRa RNA LA PCR Kit(AMV) Ver.1.1)
■ 操作手順
(1)逆転写反応
- 下記に示す反応液を調製する。
| 試薬 | 使用量 | 最終濃度 |
| MgCl2 | 2 μl | 5 mM |
| 10 × RNA PCR Buffer | 1 μl | 1 × |
| RNase Free dH2O | 4.25 μl | |
| dNTP Mixture(各10 mM) | 1 μl | 各1 mM |
| RNase Inhibitor | 0.25 μl | 1 U/μl |
| AMV Reverse Transcriptase XL*1 | 0.5 μl | 0.25 U/μl |
Random 9 mers
or
Oligo dT-Adaptor Primer
or
特異的下流PCRプライマー
(R-1 Primer) |
0.5 μl |
2.5 μM
or
0.125 μM
or
1 μM |
Positive Control RNA
or
Experimental Sample |
0.5 μl |
[1 ×105 copies]
or
[≦ 500 ng total RNA] |
| Total | 10 μl/sample | |
*1 AMV Reverse Transcriptase XLはcDNAに結合しているため、そのままPCRを行うと反応を阻害する。(1)-1の反応液の場合、99℃、5分でAMV Reverse Transcriptase XLは失活し、PCRに対する阻害もなくなる。もし、Reverse Transcriptaseの濃度が増えると不活性化が難しくなるので、長鎖のRNAの場合はReverse Transcriptaseの量を増やすよりも、反応時間を長くすることを勧める。
- 反応に用いるプライマーは、Random 9 mers、Oligo dT-Adaptor Primer、特異的下流PCRプライマー(Control RNAの場合はR-1 Primer)のいずれかを選ぶ。
調製済のチューブをサーマルサイクラーにセットし、次のプログラムで反応を行う。
| (30℃、10 min)*2 | 1 cycle |
| 42~60℃*3、15 min~30 min |
| 99℃、5 min*4 |
| 5℃、5 min |
*2 プライマーにRandom 9 mersを用いる場合は、Random 9 mersがサンプルRNAと42~60℃で充分アニーリングできるような長さになるまで伸長するように、あらかじめ30℃で10分間逆転写反応を行うこと。
*3 AMV由来Reverse Transcriptaseは60℃でも逆転写反応を行うことができる。ただし、高温で反応性の悪い場合は42℃付近での反応を勧める。
*4 長鎖を増幅する場合は、1stストランドcDNAにニックなどのダメージを与えないように70℃、15 minの失活操作を行うこと。
(2)PCR反応
- 下記に示す反応液を調製する。
| 試薬 | 使用量 | 最終濃度 |
| MgCl2 | 3 μl | 2.5 mM |
| 10×LA PCR Buffer II(Mg2+ Free) | 4 μl | 1× |
| 滅菌精製水 | 31.75 μl | |
| TaKaRa LA Taq | 0.25 μl | 12.5 U/50 μl |
上流PCRプライマー
(Control RNAの場合F-1 Primer) | 0.5 μl | 0.2 μM |
下流PCRプライマー*5
[Control RNAの場合R-1 Primer、またはM13 M4 Primer
(逆転写の際Oligo dT-Adaptor Primerを用いた場合)] |
0.5 μl | 0.2 μM |
| Total | 40 μl/sample |
|
*5 逆転写反応で下流PCRプライマーを用いた場合は、下流PCRプライマーの代わりに滅菌精製水を0.5 μl加える。
- 1. の反応液40 μlを(1)-2.で逆転写反応を終了したチューブに添加する。
- マイクロ遠心機で約10秒間遠心する。
- 調製したチューブをサーマルサイクラーにセットし、至適プログラムで増幅させる。
| 94℃、 2 min | 1 cycle |
| 94℃、 30 sec | 25~35 cycles |
| 55~65℃、 30 sec |
| 72℃、 X min*6
|
*6 約 1 kb/1 minで設定する。
プライマーのTm値が高い場合には、シャトルPCR (2ステップPCR)も有効である。
| 94℃、 2 min | 1 cycle |
| 94℃、 30 sec | 25~35 cycles |
| 65~68℃、 X min*6
|
*6 68℃の場合、約 1 kb/1 minで設定する。
- 反応終了後、反応液の一部(5~10 μl)で、アガロースゲル電気泳動を行い、反応産物を確認する。PCR増幅産物は解析するまで凍結保存しておく。
表1 コントロールRNAを用いた場合の増幅断片(bp)
| 逆転写反応primer | PCR primers
| 増幅断片
|
| Oligo dT-Adaptor Primer
| F-1とM13 Primer M4
またはF-1とR-1
| 約1.2 kb
462 bp
|
| Random 9 mers | F-1とR-1
| 462 bp
|
| Control R-1 Primer | F-1とR-1
| 462 bp
|
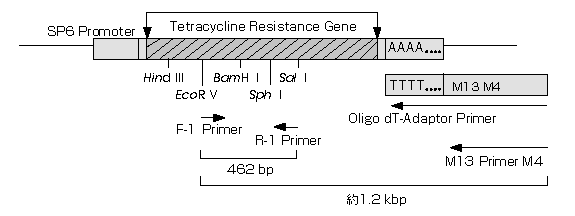
図1 Positive Control RNA:各プライマーを用いた際の増幅断片
■ PCRの条件について
- アニーリング温度
Positive Control RNAの場合は60℃で行うが、実際のサンプルの場合は条件が変わる。長鎖の増幅には25 mer程度のプライマーを使用することが多いため、通常、55~65℃の範囲で至適温度を検討する。
- 伸長時間
伸長時間はターゲットの長さに応じて設定する。通常、68~72℃で約 1 kb/1分を目安とする。
- サイクル数
cDNA量が少ない場合は、40~50 cycles行う必要がある。
TaKaRa RNA LA PCR™ Kit (AMV) Ver.1.1

