核酸電気泳動
試薬
NuSieve GTG Agarose
トリス酢酸緩衝液(pH8.0)〔TAEと略記〕
染色液 500 μg/L エチジウムブロマイド
トリス酢酸緩衝液(pH8.0)〔TAEと略記〕
| 40 mM | Tris-HCl |
| 20 mM | 酢酸ナトリウム |
| 2 mM | EDTA |
器具
| ヒートスターラー台、スターラーバー(大型) | 1組 | |
| 先を太くしたパスツールピペット | 1本 | |
| 65℃に保温可能な温浴槽 | 1槽 | |
| 電気泳動装置EP500TまたはEP600T | 一式 | |
| UVイルミネーター | ||
操作手順
- アガロースの溶解
1)アガロース6 gを150 mlのTAEに少量ずつ加え撹拌する。
2)完全に分散し、塊が認められなくなったことを確かめてから加熱スイッチを入れ、60~70℃に保ち、スターラーで撹拌する(完全に溶けない場合は、グラスウールで塊を除去して使用する)。
3)溶かしたアガロースは、60~65℃の温浴で保温しておく。 - ゲルの作製
1)ゲルトレーを泳動槽にセットし、トレーの両側にゲルトレー用間仕切り板を差し込む(アガロースが漏れないようにきっちりと差し込むこと)。
2)サンプルコーム等のセットが全て完了してからゲルを流し込む。
3)固化後、TAEをゲル上3 mmまで入れ、コームを注意して抜く(TAEで満たす前にコームを抜くと、ウェルが乾燥してしまうので注意)。 - 試料およびマーカーのアプライと泳動
1)ウェルに、サンプル、マーカー(BPB)を分注。
2)70 V、約3時間で泳動が完了する(5 V/cmゲル)。 - 染色
染色液に30分間浸漬する。 - 脱色
蒸留水に15分間静置浸漬する。これを2回繰り返す。
結果
UVイルミネーターにより、染色バンドを観察する。
図2 核酸アガロース電気泳動
図2 核酸アガロース電気泳動
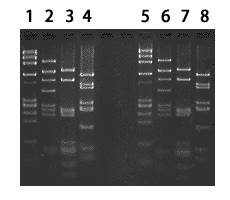 |
4 μg DNA
Lane 1:φX174-Hae III
2:pBR322-Alu I
3:pUC19-Alu I
4:pUC19-Hae III
2 μg DNALane 5:φX174-Hae III
6:pBR322-Alu I
7:pUC19-Alu I
8:pUC19-Hae III |
