ご使用者様インタビュー:マウスでの脊髄損傷部の単一核トランスクリプトーム解析
大阪大学大学院医学系研究科 分子神経科学
依藤 依代先生

左:山下 俊英先生、中央:依藤 依代先生、右:辻岡 洋先生
大阪大学大学院医学系研究科 分子神経科学研究室
依藤 依代先生
マウスの脊髄損傷部の単一核RNAシーケンスにICELL8 Single-Cell Systemをご使用いただいた大阪大学 依藤先生にインタビューを行いました。ICELL8を使用して取得されたデータをご紹介いただくとともに、ICELL8の使用感や、実験のデザイン段階や情報解析において試行錯誤された点など、大変興味深いお話をお伺いしました。現在シングルセル解析実験を実施されている方はもちろんのこと、これから実施を検討されている方も是非ご覧ください。

左:山下 俊英先生、中央:依藤 依代先生、右:辻岡 洋先生
大阪大学大学院医学系研究科 分子神経科学研究室
■インタビュー
-
ご研究内容について教えてください。
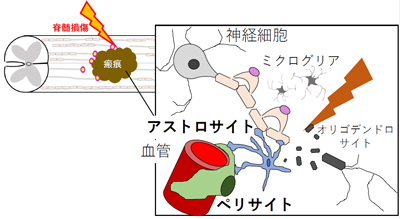
脊髄損傷の研究をマウスで行っています。脊髄が損傷されると瘢痕が形成され、損傷部の軸索再生を阻害することがわかっています。
瘢痕は再生を促進・阻害する細胞が混在していますがその区別ができなかったので、シングルセル解析を行いたいと考えました。模式図:瘢痕は様々な細胞により構成されている
- マウスの脊髄損傷部の単一核RNAシーケンスにICELL8システムをご使用いただきましたが、結果はいかがでしたか。
今回の実験では、平均3,000遺伝子以上を検出することができました(図1)。他の装置と比べると比較的多くの遺伝子を検出でき、よかったと思います。また、二次解析で、次元圧縮&可視化を行うと、きれいに細胞種ごとにクラスターに分かれ、マウスの脊髄損傷部で特異的に増加する細胞クラスター、および、特徴的な遺伝子を見つけることができました(図2)。
参考文献:核単離プロトコール
Using single nuclei for RNA-seq to capture the transcriptome of postmortem neurons
Suguna Rani Krishnaswami et al.
Nature Protocols volume 11, pages499-524(2016)
https://www.nature.com/articles/nprot.2016.015
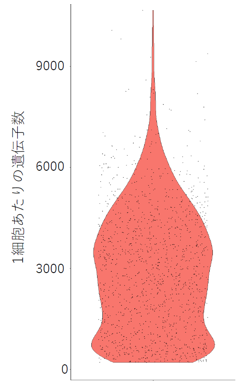
図1.1細胞あたりの遺伝子数 平均3,000の遺伝子以上を検出することができた。
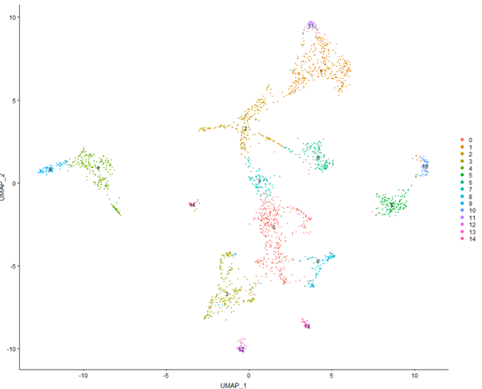
図2. UMAP解析結果 細胞種ごとにクラスターに分かれ、マウスの脊髄損傷部で特異的に増加する細胞クラスター、および、特徴的な遺伝子を見つけることができた。
- UMAP解析結果では非常にきれいにクラスターに分かれていますが、情報解析の際に心がけたことがあれば教えてください。
過去の文献を参考にしながら、解析を繰り返しました。今回の実験で終わりではなく、得られた見識について別の角度からウェットの検証実験を行い、バイオロジカルな裏付けをとることが重要であると思っています。この検証実験に関しては今後の課題として取り組む予定です。 - ICELL8システムを用いてよかった点はありますか。
ICELL8では画像確認によりダブレットを解析から除けるため、シーケンスのリードをターゲットのシングルセルのみにあてることができることはよいと思います(図3)。
また、シングルセル解析では、バッチエフェクトを考慮するべきと言われることがよくありますが、他のシステムでは1回のランで完了するため、バッチエフェクトを考慮した実験系を組むことが難しい場合があります。今回のICELL8を用いた実験の場合は、1枚のチップにエリアを分けて異なる種類のサンプルを分注し、それを4枚のチップで繰り返すことでバッチエフェクトを考慮した実験系をうまく組むことができました(図4、図5)。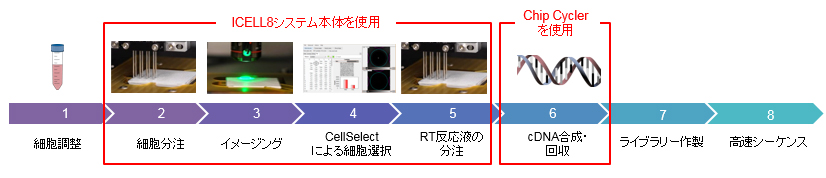
図3.ICELL8システムを用いた解析フロー例(3'DE解析の場合) ICELL8 Chip上のナノウェルに細胞サンプルを分注後、システム本体に内蔵された顕微鏡により全ウェルのイメージングを行う。専用のCellSelectソフトウェアによる画像解析後、選択したウェルのみにRT反応液を分注し、後の解析に用いる。
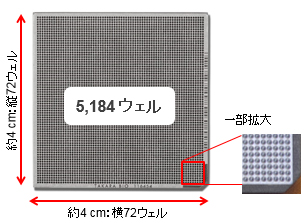
図4.4センチ四方に5,184個のナノウェルを搭載したICELL8 Chip 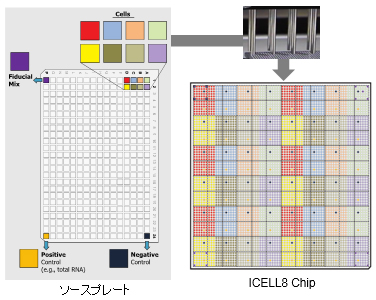
図5.ソースプレートのレイアウトとICELL8 Chipへの分注パターン 最大8種類の細胞サンプルを1枚のchip上に分注し、一度に解析することが可能。
- ICELL8システムのデメリットはありますか。
ICELL8の場合、1チップ=5,184ウェルのうち、ポアソン分布に従って理論上1,200個~1,500個のウェルにシングルセルが分注されますが、他のシステムに比較すると取得できる細胞数が少ないことがデメリットかと思います。しかし細胞数が少ないと、シーケンスの際、1細胞あたりのリードディプスをかせぐことができるので、「なるべく深く読む」ことを用途とした実験の場合、それほど問題にならないのかもしれません。また、ICELL8に限らず、シングルセル解析全般にいえることですが、コストが高くなってしまうこともデメリットだと思います。 - 今回の単一核RNAシーケンス解析を実施されたご研究の中で、苦労された点や工夫された部分があればお教えください。
自身のサンプルがICELL8でシングルセル化できるかを事前に確認するため、Well barcodeがプリントされていないブランクチップを活用してシングル核の分注検討を行いました。スターティングサンプルの濃度調整がICELL8で効率的にシングルセルを取得するための非常に重要なファクターなのですが、このブランクチップ試験を行って、初めてその重要性に気づきました。このブランクチップを用いた試験をたくさん行えば、より最適な条件で本番の試験に挑むことができるのですが、ブランクチップ試験のコストも低いものではないので、気軽に行うことは難しいです。今後、ICELL8の実績が集積されてきたら、細胞種別の過去実績を共有してもらえると研究者にとってはかなり参考になるのではないかと思います。
また、情報解析に関しては、一次解析はタカラバイオ社提供のパイプラインで行いましたが、二次解析はフリーのソフトウェアを使用し、3ヶ月ぐらいかけて、自身でバッチエフェクトの確認や次元削減の調節などの解析を繰り返し実施しました。情報解析の勉強の一環として、学内にある"Python会”というプログラミングのサークルに参加するなど、情報収集も行いました。情報解析の部分はとても苦労しましたが、第一の難関は、黒い画面にコマンドラインで打つことのアレルギーを乗り越えることだったと思います(笑)。 - 今後の先生のご研究の展望と、これからシングルセル解析を実施される方に、ご助言やコメントなどがあればお願いします。
今後の展望としては、今回の実験で発見した候補遺伝子について、バイオロジカルな検証実験を行う予定です。
またシングルセル解析を実施するにあたっては、できれば情報解析まで自身で行うとよいかと思います。情報解析を実験の背景を把握していない別の人に頼んでも、一定の結果しか返ってこないと思うので、思うようなデータを得ることは難しいと思うからです。細胞に愛があって、自身の研究に対する想いがあって、シングルセル解析は成り立つと思います。
また、シングルセル解析はまだまだ新しい分野の技術なので、情報収集が非常に重要と感じています。研究室単位ではなかなか十分な情報が得ることが難しいので、研究室を超えて、なるべく経験者の方に話を聞くことをお勧めします。私の場合は、実験デザインから次世代シーケンスの専門家が関わってくださり、非常に参考になりました。
―ご協力ありがとうございました―
