ユーザー様実施例:標的タンパク質の細胞内局在を確認するための蛍光タグ付き標的タンパク質発現プラスミドの作製
データご提供:甲南大学 フロンティアサイエンス学部 腫瘍分子生物学研究室 杉本 渉様
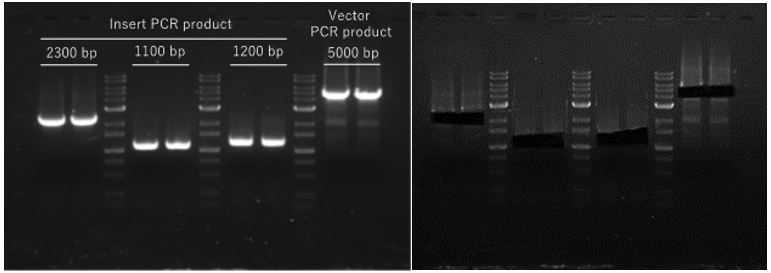
PCR産物はNucleoSpin Gel and PCR Clean-upを用いて精製し、溶出したPCR産物の濃度を測定後、In-Fusion Snap Assembly Master Mixのプロトコルに従って反応を行い、100個以上のコロニーが出現した。
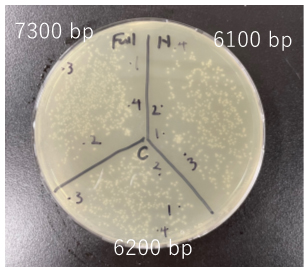
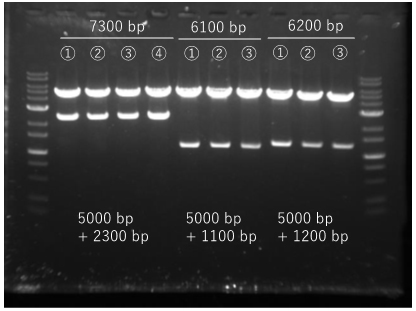
この中から、3~4個のコロニーをピックアップし、培養後アルカリミニプレップによりプラスミドを精製後、制限酵素処理並びにサンガーシーケンスにより確認を行ったところ、全てにおいて正しく導入されており、目的のプラスミドのコンストラクションが完了した。
しかし、In-Fusionで行えば、ベクター側のPCRプライマーやPCRプロダクトなどは使い回すことも可能で、その都度標的遺伝子のPCRを行うだけで非常に簡単に作成する事ができる。
何が言いたいかというと、とりあえず使ってみて欲しい。コンストラクションに革命が起きます。
■ 実験の概要
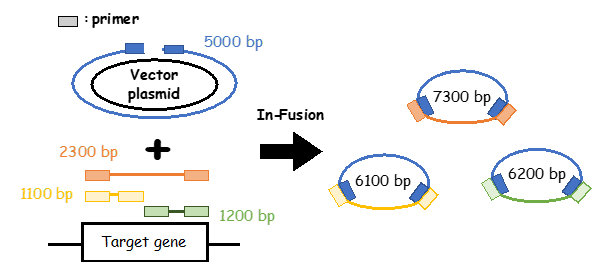
PrimeSTAR Max DNA Polymeraseを用いて、5,000 bp のベクターPCRプロダクトと1,100 bp、1,200 bp、2,300 bpの3種類のインサートPCRプロダクト(配列内に主要な制限酵素サイトを網羅)をそれぞれIn-Fusion Snap Assembly Master Mixを用いてクローニングし、合計 6,100 bp、6,200 bp、7,300 bpの計3つのプラスミド作製を試みた。
■ 結果

PCR産物はNucleoSpin Gel and PCR Clean-upを用いて精製し、溶出したPCR産物の濃度を測定後、In-Fusion Snap Assembly Master Mixのプロトコルに従って反応を行い、100個以上のコロニーが出現した。

この中から、3~4個のコロニーをピックアップし、培養後アルカリミニプレップによりプラスミドを精製後、制限酵素処理並びにサンガーシーケンスにより確認を行ったところ、全てにおいて正しく導入されており、目的のプラスミドのコンストラクションが完了した。

■ In-Fusion Snapシリーズを使った感想はいかがでしたか?
以前のIn-Fusionのキットよりもサンプルの調製が簡便で、生えてくるコロニーの数が非常に多くなっているように感じた。成功率も非常に高く、今後も使用していきたいと思う。■ In-Fusion Snapシリーズを使ったことがないユーザー様に一言お願いします。
制限酵素を使ったコンストラクションだと遺伝子内の制限酵素サイトや、ベクターのMCSの制限酵素の順番など考慮すべき事が非常に多く、慣れるまではなかなか考える事自体が難しいし、制限酵素サイトの位置や数によっては構築自体が不可能なものも出てくる。しかし、In-Fusionで行えば、ベクター側のPCRプライマーやPCRプロダクトなどは使い回すことも可能で、その都度標的遺伝子のPCRを行うだけで非常に簡単に作成する事ができる。
何が言いたいかというと、とりあえず使ってみて欲しい。コンストラクションに革命が起きます。
