50 L バイオリアクターを用いた浮遊系AAVベクターの製造例
上市されているAAV製剤において、全⾝投与のAAV必要量は1患者あたり1014〜1015 vg(vector genome)程度とされています。臨床試験や商業製造に必要なウイルスベクターを大量にかつ安定的に製造するためには、プロセス開発から商用生産までのスケーラブルな移行と培養機器の操作性の簡便さが重要なファクターとなるため、タカラバイオでは50~3,000 Lのバイオリアクターを導入しています。今回はプロセス開発に該当する50 Lのバイオリアクターを用い、弊社がAAV2をベースに開発したCereAAV*の製造例を紹介いたします。
【実験結果】
-
1. 50 L スケールとFlaskを用いた浮遊系AAVの生産培養(上流工程)
浮遊化HEK293細胞を起眠・拡大培養して50 Lのバイオリアクターに播種し、AAV産生用プラスミド3種(pAAV-ZsGreen1, pRC-Cere, pHelper)をThermo Fisher Scientific社のGibco AAV-MAX Transfection Kitを用いてトランスフェクションした。トランスフェクションの72時間後にLysis液にて細胞溶解し、CereAAVを回収してCrude培養物とした(図1)。Crude培養物のvg titerはデジタルPCR法を用いて測定した。同様の作業をFlaskスケールで並行して実施した。
これらの結果より、50 L スケールでもFlaskと同等のvg titerのAAV産生が可能であり(図2)、AAV2をベースに開発したCereAAVにとって想定通りの収量であった。
タカラバイオにて実装したバイオリアクターを用いることで、CereAAVの生産培養は「3.6×1015 vg/50 L → 1.4×1017 vg/2,000 L」の収量が期待できる。
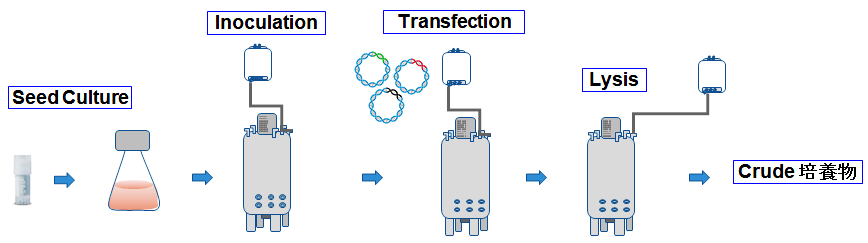
図1. AAV製造のワークフロー(培養からCrude培養物まで) 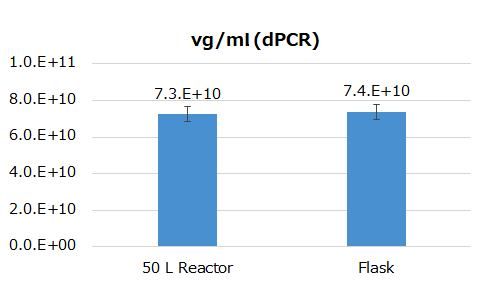
図2. Crude培養物におけるvg titer測定 -
2. 50 L スケール培養物を用いたAAVの精製(下流工程)
1.で生産したCrude培養物をフィルター処理にて清澄化後、AAV精製用レジンを用いたアフィニティークロマトグラフィーによる溶出画分を回収した。溶出画分を超遠心精製後、TFF膜を用いたバッファー交換、滅菌ろ過することで精製AAVを得た(図3)。各精製工程におけるvg titerはデジタルPCR法を用いて測定した。
清澄化後(Clarification product)のTotal vg titerを100%とした場合、各精製工程での回収率を図4に示す。最終の精製AAV(Filtered TFF product)の回収率は約25%であった。
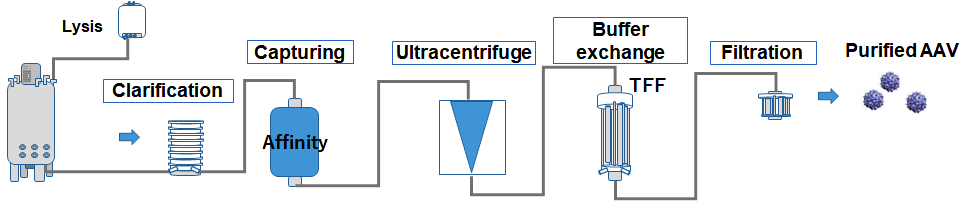
図3. AAV製造のワークフロー(Crude培養物から精製AAVまで) 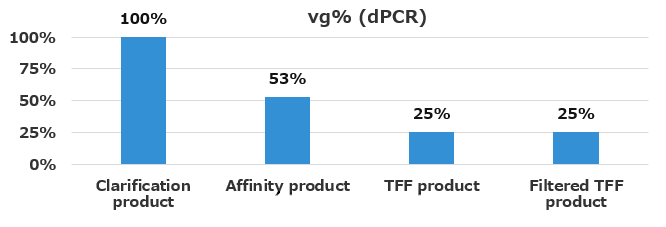
図4. 精製工程におけるウイルスベクターの回収率
タカラバイオでは様々な遺伝子治療用ウイルスベクターを製造しており、浮遊系バイオリアクターを導入したことで、より幅広く大量製造プロセス開発~製造をサポートいたします。
