本製品に付属しておりますIn-Fusion HD Cloning Kit(製品コード 639648)は、2021年6月29日(火)出荷分よりIn-Fusion Snap Assembly Master Mix(製品コード 638947)に変更いたしました。In-Fusion Snap Assembly Master Mixは従来品であるIn-Fusion HD Cloning Kitのバージョンアップ品であり、実験の操作内容等に変更はございません。(2021年6月)
カートにいれる
WEB会員ログインが必要です
製品説明
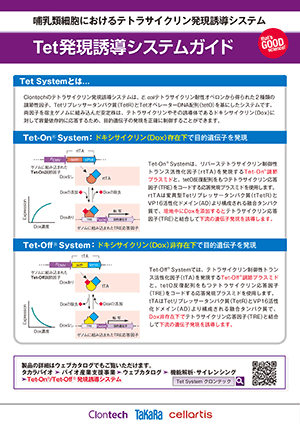
Adeno-X Adenoviral System 3 (Tet-On 3G Inducible)は、アデノウイルスベクターとテトラサイクリン発現誘導システムTet-On Systemを組合せることにより、厳密な遺伝子発現制御システムを簡単に構築できる。アデノウイルスベクターへの目的遺伝子のクローニングは、In-Fusion Snap Assembly Master Mixを使用することで通常のプラスミドと同様に行うことができ、従来のアデノウイルスベクターで必要とされていたシャトルベクターを経由する必要がない。
原理
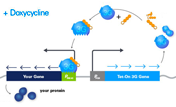
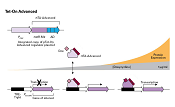
Tet-On 3G活性化因子およびTRE3Gプロモーター(PTRE3G)でコントロール可能な目的遺伝子を含む標的細胞は、テトラサイクリンアナログであるドキシサイクリン(Doxycycline:Dox)存在下でのみ、目的遺伝子を高レベルに発現する(図1)。Tet-On 3G活性化因子はDoxが結合すると、コンフォメーション変化により、TRE3Gプロモーター内のtetオペレーター配列(tetO)に結合できる。Tet-Onシステムは転写を活性化させるため、非常に低い基底発現量と高い発現量、より迅速な反応時間を得ることができる。
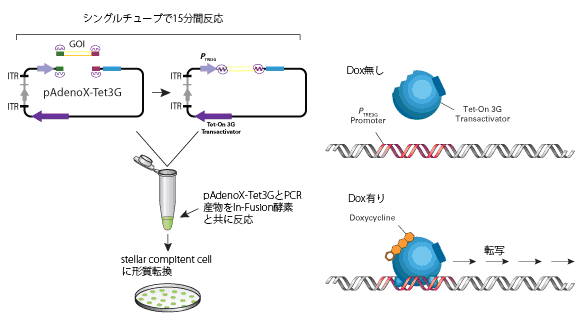
図1. AdenoX- Adenoviral System3 (Tet-On 3G Inducible) はDoxycycline存在下でのみ遺伝子発現が誘導される
システムに含まれるIn-Fusion Snap Assembly Master Mixを用いて簡単にpAdenoX-Tet3G発現ベクターに目的遺伝子をクローニングできる。

図1. AdenoX- Adenoviral System3 (Tet-On 3G Inducible) はDoxycycline存在下でのみ遺伝子発現が誘導される
システムに含まれるIn-Fusion Snap Assembly Master Mixを用いて簡単にpAdenoX-Tet3G発現ベクターに目的遺伝子をクローニングできる。
簡単なシステム構築
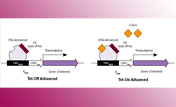
All-in-oneベクター:Tet-On 3G 活性化因子遺伝子はあらかじめアデノウイルスのE3領域に組込まれており、CMVプロモーターにより恒常的に発現する。さらに、発現させたい目的遺伝子はIn-Fusion Snap Assembly Master Mixを使用して、厳密に制御されるTRE3GプロモーターとSV40ポリAシグナル間に位置するE1領域内へクローニングすることができる。Tet-On 3G活性化因子とTRE3Gプロモーターは充分に離れた位置にあるため、CMVプロモーターのTRE3Gプロモーターへの干渉はほとんど起こらず、非常に低い基底発現と誘導時の高い発現が実現される(図2~4)。
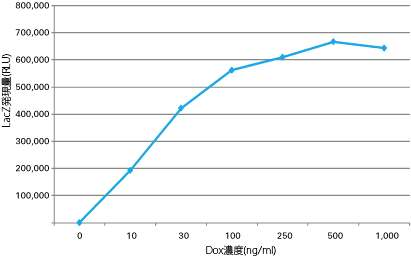
図2. 高タイター上清を用いたAdenoX Adenoviral System 3の高い誘導性の確認
Adeno-X Tet-On 3G LacZウイルスを感染させたHeLa細胞を上図のDox濃度で培養した。培養液を回収後、培地中のβ-ガラクトシダーゼ活性をLuminescent Beta-gal Reporter System 3(製品コード 631713)を用いて測定した。

図2. 高タイター上清を用いたAdenoX Adenoviral System 3の高い誘導性の確認
Adeno-X Tet-On 3G LacZウイルスを感染させたHeLa細胞を上図のDox濃度で培養した。培養液を回収後、培地中のβ-ガラクトシダーゼ活性をLuminescent Beta-gal Reporter System 3(製品コード 631713)を用いて測定した。
高感度、低バックグラウンド
Tet-On 3Gシステムは2つの因子を最適化することにより、高感度かつ低バックグラウンド誘導発現が可能である。
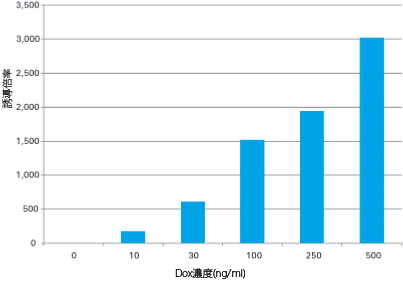
図3. Adeno-X Tet-On 3Gにより、非常に高い誘導倍率を得ることができる
誘導倍率は誘導、非誘導間で3,000倍以上である。同じ量の高タイター上清を使用し、HeLa細胞にAdeno-X Tet-On 3G Luciferase Virusを感染させ、表中で示したDox濃度で培養を行った。その後、培地を回収しルシフェラーゼアッセイを行った。
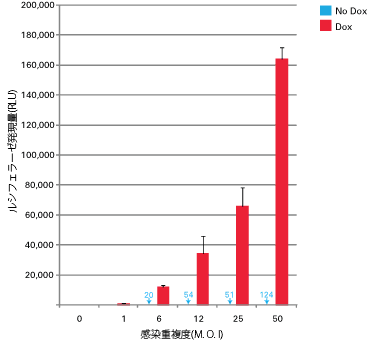
図4. M.O.I上昇に伴い増大する発現量
ルシフェラーゼを発現するpAdenoX-Tet 3GアデノウイルスのM.O.Iを変化させてHeLa細胞への感染を行った。 4時間後、Doxを含むもしくは含まない新鮮な培地と置換した。細胞を回収後、ルシフェラーゼ活性測定を行ったところ、最大発現量はM.O.Iの上昇に伴い増大した。また、同様にバックグラウンドの発現量もわずかながら上昇した。
表1. Adeno-X Systemと競合製品の比較
- TRE3Gプロモーター塩基配列の改良により、従来のTet-On Systemよりもプロモーターからのバックグラウンド発現が非常に低く抑えられている。
- Tet-On 3G 活性化因子―従来の活性化因子と比較して明らかにドキシサイクリンに対する感度が向上している。

図3. Adeno-X Tet-On 3Gにより、非常に高い誘導倍率を得ることができる
誘導倍率は誘導、非誘導間で3,000倍以上である。同じ量の高タイター上清を使用し、HeLa細胞にAdeno-X Tet-On 3G Luciferase Virusを感染させ、表中で示したDox濃度で培養を行った。その後、培地を回収しルシフェラーゼアッセイを行った。

図4. M.O.I上昇に伴い増大する発現量
ルシフェラーゼを発現するpAdenoX-Tet 3GアデノウイルスのM.O.Iを変化させてHeLa細胞への感染を行った。 4時間後、Doxを含むもしくは含まない新鮮な培地と置換した。細胞を回収後、ルシフェラーゼ活性測定を行ったところ、最大発現量はM.O.Iの上昇に伴い増大した。また、同様にバックグラウンドの発現量もわずかながら上昇した。
表1. Adeno-X Systemと競合製品の比較
| Adeno-X | Competitor | |
|---|---|---|
| クローニング所要時間 | 2~3日 | 8日 |
| クローニング手順 | ・簡単 ・実働30分 | ・複雑 ・長時間 |
| クローニング技術 | In-Fusion反応 | 大腸菌での相同組換え |
| シャトルベクターへの載換え | 必要無し | シャトルベクターへの載換えが必要 |
| ウイルスDNA量 | 高い | 組換え株のため低い |
| 大腸菌株 | 添付のStellar competent cell | 2株必要 |
| クローニング効率 | 10個中9個は陽性クローン | 10個中1~3個が陽性クローン |
| スクリーニング方法 | PCRベース | ミニプレップ後の制限酵素処理 |
| 発現誘導 | Tet-On 3Gによる厳密な制御 | 今のところできない |
| 蛍光タンパク質を用いた観察 | ・赤色および緑色 ・明るく長持ち | ・緑色のみ ・蛍光が弱い |
| 複数断片のクローニング | 1回の操作で可能 | 複数の操作が必要 |
究極の柔軟性 1反応で変異体や融合タンパク質を作製
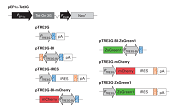
In-Fusionクローニングを利用することにより、pAdeno-X Tet3Gベクターに複数のDNA断片を1回の反応で同時にクローニングすることができる。即ち、1回の操作で目的遺伝子と蛍光タンパク質またはタグとの融合タンパク質を作製したり、目的遺伝子に点変異を加えることができる(3)。まず、PCR産物を2種類用意し、それぞれの末端をpAdenoX-Tet3Gベクターと15 bp相同性を持つように設計する。もう一方の末端はそれぞれのPCR産物のもう一方の末端と15 bp相同性を持つように設計する。両断片の連結領域は融合タンパク質の連結部分もしくは点変異を導入した配列となる(図5)。
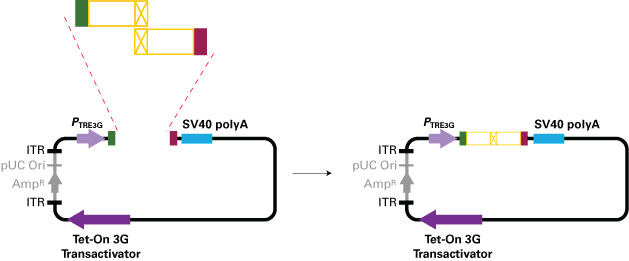
図5. In-Fusionを用いたクローニングと点変異の導入法

図5. In-Fusionを用いたクローニングと点変異の導入法
内容
| (1) | Linearized pAdenoX-Tet3G Vector DNA |
| (2) | Adeno-X Screening Primer Mix 3 |
| (3) | Adeno-X Control Fragment |
| (4) | In-Fusion Snap Assembly Master Mix(製品コード 638947) |
| (5) | NucleoSpin Gel and PCR Clean-up(製品コード 740609.10) |
| (6) | Stellar Competent Cells(製品コード 636763) |
| (7) | NucleoBond Xtra Midi kit(製品コード 740410.10) |
| (8) | Tet System Approved FBS, US Sourced(製品コード 631105) |
保存
| 室温: | (5)、(7) |
| -20℃ | (1)、(2)、(3)、(4)、(8)および(6)中のSOC MediumとTest plasmid |
| -70℃ | (6)中のcompetent cell |
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。