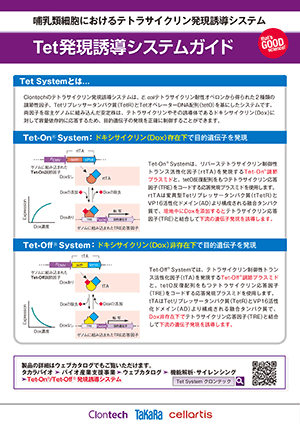
Clontechのテトラサイクリン誘導発現系は、E. coliテトラサイクリン耐性オペロンから得られた2種類の調節性因子、Tetリプレッサータンパク質(TetR)とTetオペレーターDNA配列(tetO)を基にしたシステムで、哺乳類細胞において導入遺伝子発現を正確に調節する強力なツールである。Tet調節システムの性能を向上させたTet-Off AdvancedおよびTet-On Advanced Inducible Gene Expression Systemの開発により、その用途はさらに拡大した。
各システムは哺乳類細胞で効率よく働くよう最適化されている。(図1)
・Tet-Off Advanced / Tet-On Advanced調節ベクター
調節ベクターが発現するテトラサイクリン制御性トランス活性化因子(tTA-AdvancedまたはrtTA-Advanced)は、TetRと3つのVP16活性化最少ドメインから構成される融合タンパク質である(1)。両システムのテトラサイクリン制御性トランス活性化因子は逆の作用を提供する。
すなわち、Tet-Off AdvancedシステムのtTA-Advancedは誘導物質ドキシサイクリン(Dox)非存在下でテトラサイクリン応答因子と結合して目的遺伝子の発現を高度に誘導し、一方、Tet-On AdvancedシステムのrtTA-AdvancedはDox存在下でテトラサイクリン応答因子と結合して目的遺伝子の発現を高度に誘導する。
・応答発現ベクター pTRE-Tight
プロモーター内に、tetO反復配列をもつテトラサイクリン応答因子の改良型配列TRE-Tightをコードしており、トランス活性化因子との結合により目的遺伝子の発現を効率よく誘導する。
・Tet-Off Advancedシステムは、Dox非存在下で目的遺伝子を厳密に発現誘導する。
・Tet-On Advancedシステムは、Dox存在下で目的遺伝子を厳密に発現誘導する。
両因子を宿主ゲノムに組み込んだ二重安定発現細胞株は、Doxに対して容量依存的に応答するため、正確な調節下で目的遺伝子を発現させることができる(図2)。Tet-Advanced システムの最大発現レベルは非常に高くかつ正確にコントロールされている。樹立済みのTet-Advanced Cell Linesを利用すると安定発現細胞株の構築期間を大幅に短縮可能である(図3)。
[Tet-On Advancedの場合]
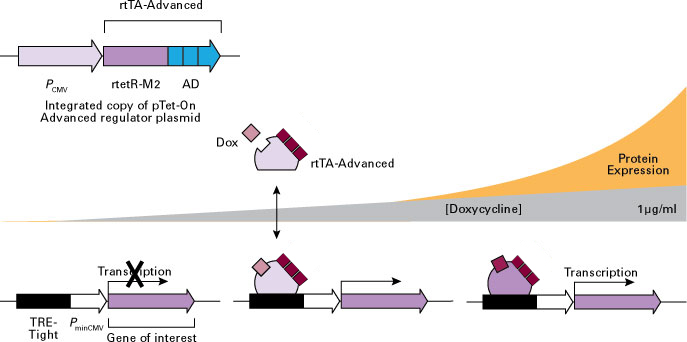
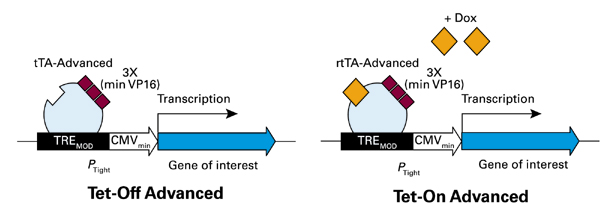
図1. Tet-Off Advanced / Tet-On Advancedシステムでの誘導発現
テトラサイクリン調節性トランス活性化因子タンパク質(tTA-AdvancedおよびrtTA-Advanced)は単純ヘルペスウイルスの3つの最小VP16活性化ドメイン(AD)にTetR由来のDNA結合ドメインを融合させた融合体で、哺乳類細胞内での発現に至適化されている。tTA-Advancedはドキシサイクリン非存在下で、rtTA-Advancedはドキシサイクリン存在下でTRE-Tightと結合し、下流遺伝子の転写を活性化させる。
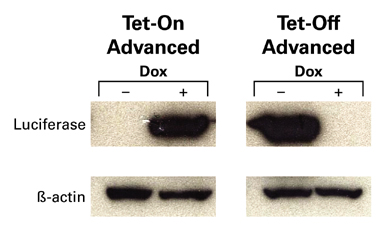
図2. Tet-On Advanced / Tet-Off Advancedシステムによるルシフェラーゼ遺伝子の発現調節をウェスタンブロッティングで検証
Tet-On AdvancedまたはTet-Off Advanced調節因子を安定に発現するHEK 293細胞にpTRE-Tight-Lucプラスミドを導入し48時間後、Doxの存在、非存在下でルシフェラーゼの発現レベルを確認した。それぞれの誘導条件下では高いルシフェラーゼ発現が見られ、非誘導条件下での発現はほとんど見られなかった。(β-actinは内部コントロールとして使用)
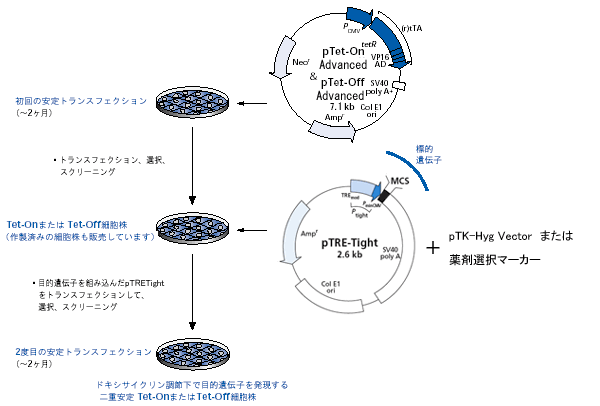
図3. Tet調節性発現系の作製
一般的にTet-On/Tet-Off Advanced二重安定細胞株を作製するには、トランスフェクションを2回連続して行う。最適な誘導能と低バックグラウンドを確実にするために、各トランスフェクションの後には複数のクローン細胞株をスクリーニングする。樹立済みのTet-Advanced Cell Linesを利用すると安定発現細胞株の構築期間を大幅に短縮可能である。
各システムは哺乳類細胞で効率よく働くよう最適化されている。(図1)
・Tet-Off Advanced / Tet-On Advanced調節ベクター
調節ベクターが発現するテトラサイクリン制御性トランス活性化因子(tTA-AdvancedまたはrtTA-Advanced)は、TetRと3つのVP16活性化最少ドメインから構成される融合タンパク質である(1)。両システムのテトラサイクリン制御性トランス活性化因子は逆の作用を提供する。
すなわち、Tet-Off AdvancedシステムのtTA-Advancedは誘導物質ドキシサイクリン(Dox)非存在下でテトラサイクリン応答因子と結合して目的遺伝子の発現を高度に誘導し、一方、Tet-On AdvancedシステムのrtTA-AdvancedはDox存在下でテトラサイクリン応答因子と結合して目的遺伝子の発現を高度に誘導する。
・応答発現ベクター pTRE-Tight
プロモーター内に、tetO反復配列をもつテトラサイクリン応答因子の改良型配列TRE-Tightをコードしており、トランス活性化因子との結合により目的遺伝子の発現を効率よく誘導する。
・Tet-Off Advancedシステムは、Dox非存在下で目的遺伝子を厳密に発現誘導する。
・Tet-On Advancedシステムは、Dox存在下で目的遺伝子を厳密に発現誘導する。
両因子を宿主ゲノムに組み込んだ二重安定発現細胞株は、Doxに対して容量依存的に応答するため、正確な調節下で目的遺伝子を発現させることができる(図2)。Tet-Advanced システムの最大発現レベルは非常に高くかつ正確にコントロールされている。樹立済みのTet-Advanced Cell Linesを利用すると安定発現細胞株の構築期間を大幅に短縮可能である(図3)。

[Tet-On Advancedの場合]

図1. Tet-Off Advanced / Tet-On Advancedシステムでの誘導発現
テトラサイクリン調節性トランス活性化因子タンパク質(tTA-AdvancedおよびrtTA-Advanced)は単純ヘルペスウイルスの3つの最小VP16活性化ドメイン(AD)にTetR由来のDNA結合ドメインを融合させた融合体で、哺乳類細胞内での発現に至適化されている。tTA-Advancedはドキシサイクリン非存在下で、rtTA-Advancedはドキシサイクリン存在下でTRE-Tightと結合し、下流遺伝子の転写を活性化させる。

図2. Tet-On Advanced / Tet-Off Advancedシステムによるルシフェラーゼ遺伝子の発現調節をウェスタンブロッティングで検証
Tet-On AdvancedまたはTet-Off Advanced調節因子を安定に発現するHEK 293細胞にpTRE-Tight-Lucプラスミドを導入し48時間後、Doxの存在、非存在下でルシフェラーゼの発現レベルを確認した。それぞれの誘導条件下では高いルシフェラーゼ発現が見られ、非誘導条件下での発現はほとんど見られなかった。(β-actinは内部コントロールとして使用)

図3. Tet調節性発現系の作製
一般的にTet-On/Tet-Off Advanced二重安定細胞株を作製するには、トランスフェクションを2回連続して行う。最適な誘導能と低バックグラウンドを確実にするために、各トランスフェクションの後には複数のクローン細胞株をスクリーニングする。樹立済みのTet-Advanced Cell Linesを利用すると安定発現細胞株の構築期間を大幅に短縮可能である。
より優れた調節プロモーター、より優れたトランス活性化因子
TRE-TightプロモーターはDoxの非存在下でバックグラウンドの発現を抑制する。さらに新しく開発したTet-On/Off Advanced (r)tTAタンパク質は、このタンパク質自身のDoxに対する感度を増加させ、また非誘導条件下でも残存するTRE結合活性を排除する変異を含んでいる。さらに、Tet-On/Off Advanced (r)tTA遺伝子を哺乳類細胞内における発現と安定性に対して至適化した。細菌のコドンを哺乳類のコドンと置換し、mRNAの潜在的なスプライス部位を除去している。さらに、(r)tTAのオリジナルのHSV VP16転写活性化ドメインを、Tet-On/Off Advancedでは3つの活性化最小ドメインと置換した。これらの改良により、(r)tTAタンパク質の発現レベルが上昇し、その細胞毒性が低下する一方で誘導能が完全に保たれている。
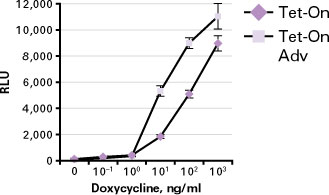
図4. HEK 293細胞においてTet-On Advanced rtTAのドキシサイクリンに対する感度はTet-On rtTAより10倍増加
pTet-OnまたはpTet-On Advancedのいずれかにより形質転換した2種類の安定なHEK 293細胞株にpTRE-2 Luciferaseを一過性にトランスフェクトした。細胞を指示濃度のDoxで処理し、トランスフェクションから48時間後にルシフェラーゼ活性を測定した。
Tet-On Advanced rtTAタンパク質の向上した安定性は、ホストクローンの作製とスクリーニングのプロセスを容易にする。pTet-On Advancedのトランスフェクションにより、強力な誘導能を持つクローンを高頻度に産生できる(図5)。Tet Advanced Systemにより理想的なクローン細胞株の樹立を実質的に確実にすることが可能である。
また、pTRE-Tightと至適化したTet-On Advanced rtTAタンパク質の組み合わせは、バックグラウンドの発現を効果的に消去し、Doxの存在下で高い誘導能を実現する(図6)。Tet-On Advancedの発現誘導レベルはオリジナルのTet-Onよりもおよそ10倍高くなり、通常は1,000~2,000倍のオーダーとなる。
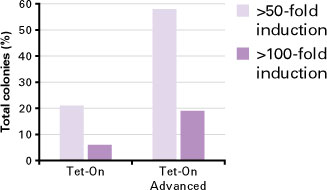
図5. Tet-On Advanced Systemは高い誘導レベルを実現するHEK 293安定細胞株を多量に産生
HEK 293細胞にpTet-OnまたはpTet-On Advancedのいずれかを脂質ベースのトランスフェクション試薬を用いてトランスフェクトした。G418による抗生物質選択に続いて、各トランスフェクションからそれぞれ36個のコロニーを単離し、培養した。次に各細胞株にpTre2-Luciferaseを一過性にトランスフェクトし、Dox 1μg/mlで48時間処理を行うか、または未処理のままとした。続いて細胞を回収し、ルシフェラーゼ活性を測定し、誘導が50倍以下、50倍以上、又は100倍以上の群に分類した。各値は50倍以上及び100倍以上まで増加した総コロニー数の割合を示している。
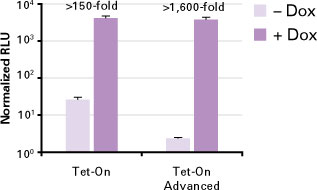
図6. Tet-On Advanced Systemはバックグラウンドの発現を抑え、Tet-On Systemよりも高い発現誘導を実現
ルシフェラーゼの誘導発現が可能なMCF-7細胞株を、Tet-On SystemまたはTet-On Advanced Systemのいずれかにより作製した。ルシフェラーゼの発現はTet-On中のTREプロモーター、またはTet-On Advanced中のTRE-Tightプロモーターによって調節される。各細胞株由来の細胞をDox 1μg/mlによる処理を行って、あるいは未処理のままで回収し、ルシフェラーゼ活性(相対的光量ユニット;RLU)を測定した。最大の誘導量は両細胞株で同様でしたが、バックグラウンドの抑制によりTet-On Advancedによる発現誘導効率が高くなった。

図4. HEK 293細胞においてTet-On Advanced rtTAのドキシサイクリンに対する感度はTet-On rtTAより10倍増加
pTet-OnまたはpTet-On Advancedのいずれかにより形質転換した2種類の安定なHEK 293細胞株にpTRE-2 Luciferaseを一過性にトランスフェクトした。細胞を指示濃度のDoxで処理し、トランスフェクションから48時間後にルシフェラーゼ活性を測定した。
Tet-On Advanced rtTAタンパク質の向上した安定性は、ホストクローンの作製とスクリーニングのプロセスを容易にする。pTet-On Advancedのトランスフェクションにより、強力な誘導能を持つクローンを高頻度に産生できる(図5)。Tet Advanced Systemにより理想的なクローン細胞株の樹立を実質的に確実にすることが可能である。
また、pTRE-Tightと至適化したTet-On Advanced rtTAタンパク質の組み合わせは、バックグラウンドの発現を効果的に消去し、Doxの存在下で高い誘導能を実現する(図6)。Tet-On Advancedの発現誘導レベルはオリジナルのTet-Onよりもおよそ10倍高くなり、通常は1,000~2,000倍のオーダーとなる。

図5. Tet-On Advanced Systemは高い誘導レベルを実現するHEK 293安定細胞株を多量に産生
HEK 293細胞にpTet-OnまたはpTet-On Advancedのいずれかを脂質ベースのトランスフェクション試薬を用いてトランスフェクトした。G418による抗生物質選択に続いて、各トランスフェクションからそれぞれ36個のコロニーを単離し、培養した。次に各細胞株にpTre2-Luciferaseを一過性にトランスフェクトし、Dox 1μg/mlで48時間処理を行うか、または未処理のままとした。続いて細胞を回収し、ルシフェラーゼ活性を測定し、誘導が50倍以下、50倍以上、又は100倍以上の群に分類した。各値は50倍以上及び100倍以上まで増加した総コロニー数の割合を示している。

図6. Tet-On Advanced Systemはバックグラウンドの発現を抑え、Tet-On Systemよりも高い発現誘導を実現
ルシフェラーゼの誘導発現が可能なMCF-7細胞株を、Tet-On SystemまたはTet-On Advanced Systemのいずれかにより作製した。ルシフェラーゼの発現はTet-On中のTREプロモーター、またはTet-On Advanced中のTRE-Tightプロモーターによって調節される。各細胞株由来の細胞をDox 1μg/mlによる処理を行って、あるいは未処理のままで回収し、ルシフェラーゼ活性(相対的光量ユニット;RLU)を測定した。最大の誘導量は両細胞株で同様でしたが、バックグラウンドの抑制によりTet-On Advancedによる発現誘導効率が高くなった。
より広い用途を実現する厳密な調節性
バックグラウンドが低く、Doxによる誘導が迅速であるTet-On Advanced Systemは、毒性のあるタンパク質の発現誘導にも極めて有用である。Tet-On Advanced Systemを、強力なアポトーシスタンパク質であるカスパーゼ-8の発現誘導が可能な二重安定HEK細胞株の作製に使用した。バックグラウンドでのカスパーゼ-8の発現が極めて低いことにより、これらの細胞のDox非存在下での正常な増殖が可能で、一方、Doxの存在下では8時間後に広範囲なアポトーシスが生じた(図7)。Tet-On Advanced Systemは、最低限のバックグラウンド発現レベル以外受容できないようなアッセイ系にも利用可能である。
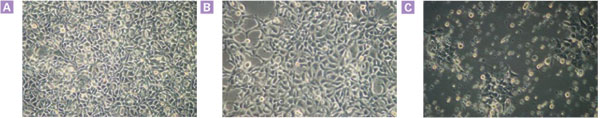
図7. ドキシサイクリンによるカスパーゼ-8の発現誘導はアポトーシスを誘導する
Tet-On Advanced Systemを用いて、プロカスパーゼ-8の発現誘導が可能な二重安定HEK 293細胞株を作製した。 Dox存在下または非存在下で細胞を8時間処理し、位相差顕微鏡(Zeiss、10X)で可視化した。
パネルA:トランスフェクトしていないHEK 293親細胞
パネルB:HEK 293-Tet-On Advanced/カスパーゼ-8、Dox非存在下
パネルC:HEK 293-Tet-On Advanced/カスパーゼ-8、Dox 1μg/mlにて処理
Doxの非存在下ではカスパーゼ-8導入遺伝子のバックグラウンドの発現が極めて低いため、パネルBの細胞は親株と極めて類似しているように見える。トランスフェクトした細胞をDox処理した結果、アポトーシスが広範囲に誘導された。

図7. ドキシサイクリンによるカスパーゼ-8の発現誘導はアポトーシスを誘導する
Tet-On Advanced Systemを用いて、プロカスパーゼ-8の発現誘導が可能な二重安定HEK 293細胞株を作製した。 Dox存在下または非存在下で細胞を8時間処理し、位相差顕微鏡(Zeiss、10X)で可視化した。
パネルA:トランスフェクトしていないHEK 293親細胞
パネルB:HEK 293-Tet-On Advanced/カスパーゼ-8、Dox非存在下
パネルC:HEK 293-Tet-On Advanced/カスパーゼ-8、Dox 1μg/mlにて処理
Doxの非存在下ではカスパーゼ-8導入遺伝子のバックグラウンドの発現が極めて低いため、パネルBの細胞は親株と極めて類似しているように見える。トランスフェクトした細胞をDox処理した結果、アポトーシスが広範囲に誘導された。
Clontechでは、レトロウイルスベクタータイプのTet-AdvancedシステムであるRetro-X Tet-Advanced Inducible Expression Systemも用意しています。
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。