NGSライブラリーの精製、サイズ分画に
- 磁性ビーズを用いたNGSライブラリーの精製、サイズ分画
- 少量(17.5 pg)サンプルから利用可能
- 150~800 bpのサイズ分画が可能
- さまざまなNGS applicationに容易に対応
- 手動と自動化装置のどちらにも対応
製品説明
NucleoMag NGS Clean-up and Size Selectは、NGSライブラリー作製において、1回または2回のサイズ分画によりDNA断片を精製すると同時に目的サイズのDNA断片を回収するためのキットである。本製品の磁性ビーズは、結合バッファーに懸濁されており、目的のDNA断片サイズに合わせて希釈率を調整して使用する。希釈率は一般的に使用される精製用のビーズを使用する場合と大きな違いはなく、NGSライブラリー調製キットのプロトコールに容易に組み込むことが可能である。
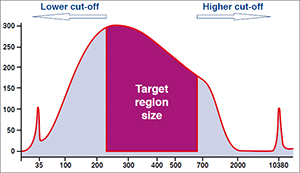
図1.DNA断片のサイズ選択
より大きなサイズまたは小さいサイズのDNAのどちらかを除去するサイズ分画では、サンプルをあらかじめ定めた比率でビーズと混合する(混合比率とサイズ分画のだいたいの大きさは下図参照)。より大きなサイズと小さいサイズの断片をカットオフする、特定サイズ領域のみのDNA分画の場合は異なった混合比率での2回の結合ステップを含む精製を行う。
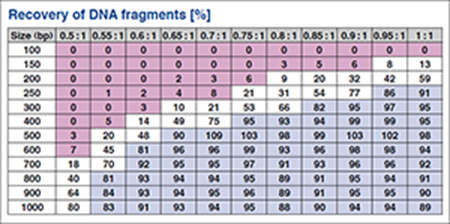
図2.さまざまなサイズ断片の回収率
DNAサイズ分画のため、各100 μl DNA溶液 (10 ng/μl)に図に示される比率(ratio=ビーズ:DNA)となるようにNucleoMag NGS Clean-up and Size Selectビーズを加えて精製を行い、各DNA断片の回収率を算出した。DNAは、100~1,000 bpサイズの混合物を使用した。
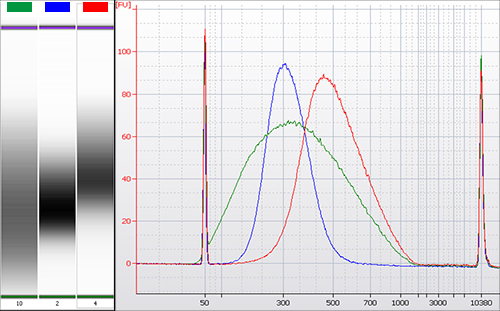
図3.両側サイズ選択
マウス組織由来のゲノムDNAを断片化後、違った比率のNucleoMag NGS Clean-up and Size Selectを使用してサイズ分画を行った。
緑:断片化DNAのサイズ分布
赤:ビーズ比率が0.4と0.6でのサイズ分画後のライブラリーサイズ分布(平均サイズ:460 bp)
青:ビーズ比率が0.55と0.8でのサイズ分画後のライブラリーサイズ分布(平均サイズ:340 bp)
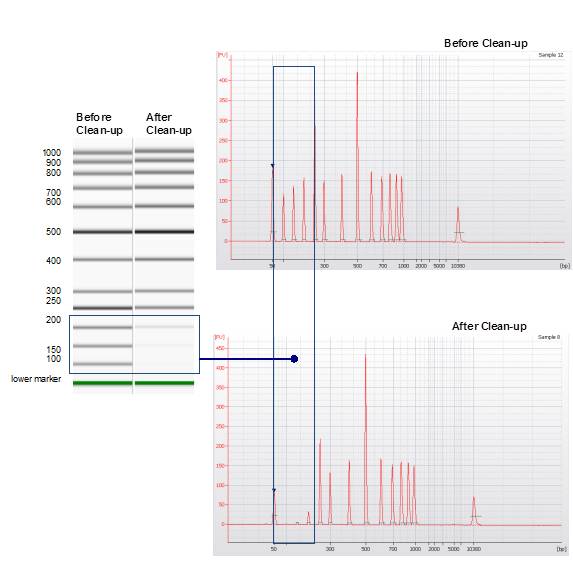
図4.短鎖DNAの除去
100~1,000 bpサイズのDNA混合物をアダプターダイマー除去のプロトコールに従ってサイズ分画を行い精製した。100~200 bpの大きさのDNA断片が取り除かれていることが示された。
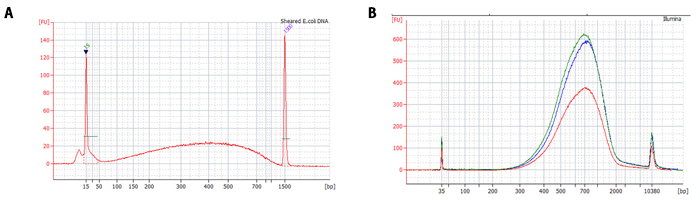
図5.NGSライブラリーからのサイズ分画
大腸菌DNAをサンプルに、TruSeq DNA PCR Free kit(Illumina社)を用いてNGS用のライブラリーを作製した。その際、DNA精製とサイズ分画は、A社磁性ビーズ(赤)、B社磁性ビーズ(青)、NucleoMag NGS Clean-up and Size Select(緑)を使用した。図Aは、精製前の断片化E. coli DNA(1 μg)を示す。図Bは、ライブラリー調製後のDNA断片の分布を示す。
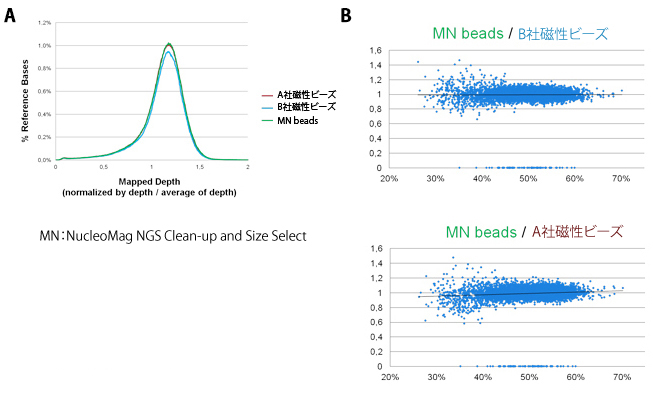
図6.サイズ分画後のシーケンス解析
図5で作製されたライブラリーを用いて実際に塩基配列解析を行い、各磁性ビーズ精製で塩基配列結果を比較した。塩基配列解析はTruSeq Rapid SBS Kit(Illumina社)を用いて、HiSeq2500で解析を行った。
A.得られた塩基配列を大腸菌ゲノムにマッピングを行い、各塩基の解析数(depth)を比較した。3つの磁性ビーズで、グラフの形状はほぼ一致しており、ゲノム全体で解析結果に差は見られなかった。
B.塩基配列解析のGC比率の影響を確認するため、横軸にGCの比率、縦軸に各ビーズ精製のライブラリー由来のread depthの比率をプロットした。3つの精製ビーズで、GCによるバイアスの違いは見られなかった。
| 原理 | 磁性ビーズ法 |
| 形状 | 高反応性超常磁性ビーズ |
| 操作 | 手動または自動化装置 |
| サンプル種 | NGSライブラリーの作製途中の反応液 |
| サンプル量 | 17.5 pg~5 μg |
| サンプル液量 | 50~150 μl |
| 回収量 | >80% |
| 溶出液量 | 10~100 μl |

図1.DNA断片のサイズ選択
より大きなサイズまたは小さいサイズのDNAのどちらかを除去するサイズ分画では、サンプルをあらかじめ定めた比率でビーズと混合する(混合比率とサイズ分画のだいたいの大きさは下図参照)。より大きなサイズと小さいサイズの断片をカットオフする、特定サイズ領域のみのDNA分画の場合は異なった混合比率での2回の結合ステップを含む精製を行う。

図2.さまざまなサイズ断片の回収率
DNAサイズ分画のため、各100 μl DNA溶液 (10 ng/μl)に図に示される比率(ratio=ビーズ:DNA)となるようにNucleoMag NGS Clean-up and Size Selectビーズを加えて精製を行い、各DNA断片の回収率を算出した。DNAは、100~1,000 bpサイズの混合物を使用した。

図3.両側サイズ選択
マウス組織由来のゲノムDNAを断片化後、違った比率のNucleoMag NGS Clean-up and Size Selectを使用してサイズ分画を行った。
緑:断片化DNAのサイズ分布
赤:ビーズ比率が0.4と0.6でのサイズ分画後のライブラリーサイズ分布(平均サイズ:460 bp)
青:ビーズ比率が0.55と0.8でのサイズ分画後のライブラリーサイズ分布(平均サイズ:340 bp)

図4.短鎖DNAの除去
100~1,000 bpサイズのDNA混合物をアダプターダイマー除去のプロトコールに従ってサイズ分画を行い精製した。100~200 bpの大きさのDNA断片が取り除かれていることが示された。

図5.NGSライブラリーからのサイズ分画
大腸菌DNAをサンプルに、TruSeq DNA PCR Free kit(Illumina社)を用いてNGS用のライブラリーを作製した。その際、DNA精製とサイズ分画は、A社磁性ビーズ(赤)、B社磁性ビーズ(青)、NucleoMag NGS Clean-up and Size Select(緑)を使用した。図Aは、精製前の断片化E. coli DNA(1 μg)を示す。図Bは、ライブラリー調製後のDNA断片の分布を示す。

図6.サイズ分画後のシーケンス解析
図5で作製されたライブラリーを用いて実際に塩基配列解析を行い、各磁性ビーズ精製で塩基配列結果を比較した。塩基配列解析はTruSeq Rapid SBS Kit(Illumina社)を用いて、HiSeq2500で解析を行った。
A.得られた塩基配列を大腸菌ゲノムにマッピングを行い、各塩基の解析数(depth)を比較した。3つの磁性ビーズで、グラフの形状はほぼ一致しており、ゲノム全体で解析結果に差は見られなかった。
B.塩基配列解析のGC比率の影響を確認するため、横軸にGCの比率、縦軸に各ビーズ精製のライブラリー由来のread depthの比率をプロットした。3つの精製ビーズで、GCによるバイアスの違いは見られなかった。
内容
・NucleoMag NGS Bead Suspension
本製品以外に必要な試薬、機器(主なもの)
・80%エタノール
・Elution buffer(10 mM Tris-HCl(pH 8)またはH2O)
・ピペットチップ(滅菌済)
・ピペット
・磁気ビーズセパレーター
NucleoMag SEP(製品コード 744900)
・磁気ビーズの分離用プレート
96-well 0.3 mL microtiterplate(Elution Plate U-bottom; 製品コード 740486.24)
・プレートシール
Self-adhering PE Foil(製品コード 740676)
・Elution buffer(10 mM Tris-HCl(pH 8)またはH2O)
・ピペットチップ(滅菌済)
・ピペット
・磁気ビーズセパレーター
NucleoMag SEP(製品コード 744900)
・磁気ビーズの分離用プレート
96-well 0.3 mL microtiterplate(Elution Plate U-bottom; 製品コード 740486.24)
・プレートシール
Self-adhering PE Foil(製品コード 740676)
保存
4℃
操作手順
2回のサイズ分画による特定サイズのDNAの精製
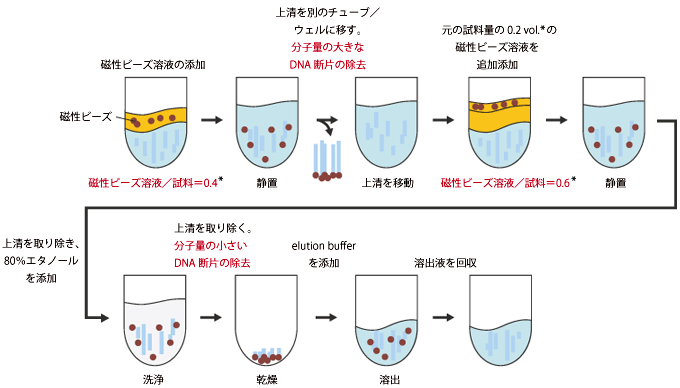
* 磁性ビーズ溶液と試料の混合比率(0.4 or 0.6)については、分画したいDNAの大きさや試料の組成に応じて適切に設定してください。

* 磁性ビーズ溶液と試料の混合比率(0.4 or 0.6)については、分画したいDNAの大きさや試料の組成に応じて適切に設定してください。
用途
- NGSライブラリーキットにおける精製やサイズ分画
- 次世代シーケンスのサンプル調製
NucleoMagはマッハライ・ナーゲル社の登録商標です。
関連製品・受託
この製品を見た人は、
こんな製品も見ています
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。





