はじめに
インターカレーター法によるリアルタイムPCR(定量PCR、qPCR)は、ターゲットごとに特別な蛍光標識プローブを用意する必要がなく、コスト的にも安価であるため、手軽に実験を行うことができる。しかし反面、インターカレーター(TB Greenなど)は配列非特異的に二本鎖DNAに結合するので、増幅自体に特異性が求められ、反応条件の検討が非常に重要となる。
ここでは、Thermal Cycler Dice Real Time System III(製品コード TP950/TP970)やSmart Cycler System/Smart Cycler II System(Cepheid社)などのリアルタイムPCR装置とインターカレーター法のqPCR試薬TB Greenプレミックスシリーズを用いて、TB Green検出系によるリアルタイムPCRを行う際のチェック項目について、できるだけ簡単にまとめた。
チェック項目は主に次の3点である。
- プライマー設計:リアルタイム検出を行う場合には、増幅産物のサイズが80~300 bpとなるように設計する(最適サイズは80~150 bp)。
- 適切な試薬を選択する。
- 鋳型の希釈系列を用いて2.で選択した試薬を用いて検量線を作成し、その直線性を確認する。直線に乗らない場合は条件検討を行う。
1. リアルタイムPCR検出におけるプライマー設計
(1) プライマーの選び方
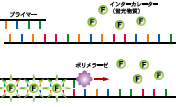
良いプライマーをデザインするということは、いかに特異的に鋳型DNAとアニールさせ、効率よく伸長反応を行わせることができるかに集約される。リアルタイム検出を行うには、増幅産物のサイズが80~300 bpになるようにプライマーを設計することを推奨する。プライマー設計用のコンピュータソフトOLIGO Primer Analysis Software(Molecular Biology Insights社)なども市販されており、それらを利用すると便利である。しかし、コンピュータ上で最適と思われるプライマーを選んでも、また、ここで述べる方法に従ってプライマーを設計しても、それで100%良い結果が保証されるわけではないので、その点を念頭におく必要がある。プライマーは、標的DNAの上流(5'側)でセンス鎖を、下流(3'側)でアンチセンス鎖を選択する(図1)。
 |
| 図1. プライマー配列の選択 |
プライマーのデザインにおける留意点
- プライマーのサイズ
プライマーサイズは17~25塩基程度が望ましく、GC含量は40~60%(できれば45~55%)が望ましい。 - プライマー間の相補性
2つのプライマー同士がアニールしないようにする。特に各プライマーの3'末端同士が3塩基以上連続して相補的にならないように設計すれば、プライマーダイマーの形成(図2)による増幅効率の低下を防ぐことができる。
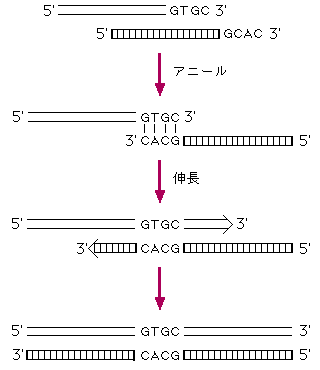
図2. プライマーダイマ-の形成 - プライマー内の二次構造形成
プライマー自身が二次構造を形成すること(図3)を避けるために、4塩基以上の自己相補配列を含まないようにする。
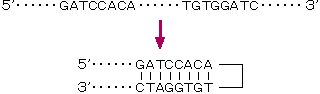
図3. プライマー自身の2次構造の形成 - GC含量
GC含量は40~60%前後とし、部分的にGCあるいはAT-richにならないようにする。また、プライマーの3'末端と鋳型DNAが安定して結合するように、特にプライマーの3'側がAT-richまたはGC-richにならないように注意する。プライマーの3'末端がGC-richの場合は非特異的産物が生じやすいので、注意が必要である。
具体的には、以下のようなプライマーは避けた方がよい。
(1)3'末端がGCリッチなもの
・3'末端の 3塩基にGCが2つ以上
・3'末端の 5塩基にGCが3つ以上
(2)3'末端がプライマー内部に相補する配列を持っているもの
・3'末端がGCのとき:2塩基以上が一致するもの
・3'末端がATのとき:3塩基以上が一致するもの
(3)3'末端がTのもの
(1)(2)ではプライマーダイマーなどの非特異的産物の増幅が起こりやすく、(3)では“T”の特異性が低いためミスマッチアニーリングを起こしやすくなる。 - Tm値
Tm値とは、二本鎖DNAの50%が一本鎖DNAに解離する温度(melting temperature)のことである。プライマーが鋳型DNAにアニーリングして、伸長反応が始まるためには、アニーリング温度をプライマーのTm値以下に設定する必要がある。しかし、温度を下げすぎると非特異的なアニーリングが起こり、特異的な増幅効率が低下する。いくつかのプライマー対の候補がある場合は、特異性を高くするために、通常、Tm値の高い対を選ぶ。
プライマーのTm値は上流プライマーと下流プライマーで大きく異ならないことが重要である。なお、Tm値の計算は専用のソフトウェアで行い、下記の範囲が望ましい。
OLIGO:63~68℃
Primer3:60~65℃
- ゲノム構造の考慮(RT-PCR用プライマー)
可能な限りゲノムDNA由来の増幅が起こらないようなプライマーを設計する。RT-PCRではmRNAの検出を行うが、ゲノムDNAが混入しているRNAサンプルでは、ゲノムDNAもPCRの鋳型となりえる。このようなことを避けるために、RNAサンプルを前もってDNaseI処理する方法もあるが、あらかじめゲノムDNA由来の増幅が起こらないようなプライマーを設計することもできる。このようなプライマーを設計するには、目的遺伝子のゲノム構造が分かっている必要があるので、公共のデータベースを利用して調べる。
UCSC Genome Browser ( Human, Mouse, Rat etc. )
http://genome.ucsc.edu/cgi-bin/hgGateway
ゲノム構造が分かったら、サイズの大きなイントロンを選んで、その前後のエキソンにForward、Reverseのプライマーをそれぞれ設計する。Smart Cyclerでは、通常、増幅サイズが500 bpを超えるようなプライマーペアでは増幅が起こりにくく、ゲノムDNA由来の増幅を避けることができる。それ以下の小さなサイズのイントロンが存在する場合にも、ゲノムDNA由来の増幅産物とcDNA由来の増幅産物とではサイズが異なるので、増幅産物の融解曲線分析により区別することができる。
なお、遺伝子発現解析を行う場合にはタカラバイオのPerfect Real Timeサポートシステム(PRTSS) for インターカレーターでリアルタイムRT-PCR用のプライマーを検索して利用することを推奨する。本システムは、インターカレーター法によるリアルタイムRT-PCR用に最適化されたプライマーを検索・オンライン注文するためのシステムである。ヒト、マウス、ラット、イヌ、ウシ、ニワトリ、イネ、シロイヌナズナのRefSeq登録遺伝子または、Ensembl Plants登録遺伝子に対して網羅的にリアルタイムRT-PCR用プライマーを設計している。ターゲット遺伝子を検索し、希望するプライマーセットを選択すれば簡単にオンラインで注文でき、わずらわしいプライマー設計が不要となる。Perfect Real Timeシリーズの試薬と組み合わせて用いることで反応条件の至適化作業も不要となる。
2. 適切な試薬の選択
タカラバイオでは、精度の高いインターカレーター法(TB Green使用)によるリアルタイムPCR解析を効率よく行っていただくため、特長の異なる5種類のリアルタイムPCR用プレミックス試薬を用意している。
・TB Green Fast qPCR Mix(製品コード RR430S/A/B)プライマーダイマーの出現頻度が低い高速反応と幅広いダイナミックレンジでの正確なターゲットの定量、検出を再現性よく実現する。
・TB Green Premix Ex Taq (Tli RNaseH Plus)(製品コード RR420S/A/B)
増幅効率に優れたリアルタイムPCR試薬。ご自身で設計したプライマーを使用される場合には、本試薬の使用を推奨する。
・TB Green Premix Ex Taq II (Tli RNaseH Plus)(製品コード RR820S/A/B)
増幅効率と反応特異性のバランスが良いリアルタイムPCR試薬。Perfect Real Timeサポートシステム(PRTSS)のプライマーと組み合わせて用いる場合は第一に推奨する。(注:Smart Cycler System/Smart Cycler II Systemには、PRTSSのプライマーにもRR420A/Bの使用を推奨)
・TB Green Premix DimerEraser (Perfect Real Time)(製品コード RR091A/B)
極めて高い反応特異性を実現するリアルタイムPCR試薬。非特異的増幅産物を生じやすいプライマー対を用いる際に精度を上げたい場合など、より高い反応特異性を求める場合に推奨する。
・TB Green Premix Ex Taq GC (Perfect Real Time)(製品コード RR071A/B)
GCリッチターゲットでの反応性を高めたリアルタイムPCR試薬。GC含量 60~70%のターゲットに対して高い解析精度を求める場合に推奨する。
(1) 反応条件の検討
1)反応液上記のリアルタイムPCR試薬はそれぞれ最適濃度のTB Greenを混合済みの2×プレミックスタイプであり、反応条件の検討は基本的に不要である。プライマー濃度もそれぞれの説明書で指定する初期条件で通常良好な反応が見られるが、場合によっては下記のように検討する。
- プライマー濃度:終濃度0.1~0.5 μMの範囲で最適な濃度を検討する。プライマー濃度が高いほど反応性が良くなるが、プライマーダイマーが生成する危険性も高くなる。ターゲットが効率よく増幅し、プライマーダイマーが生成しにくい条件を設定する。
各試薬の説明書に示す標準プロトコールで反応を行う。
RR430、RR0420、RR820、RR071では、2 step PCRが標準プロトコールである。
| 初期変性 | 2 step PCR サイクル数:40 | 融解曲線 |
| 95℃、30秒 | 変性:95℃、5秒 アニーリング/伸長反応:60℃、10~30秒 (Thermal Cycler Dice Real Timeでは30秒、Smart Cyclerでは20秒) |
Start:60℃ End:95℃ |
RR091では、3 step PCRが標準プロトコールである。
| 初期変性 | 3 step PCR サイクル数:40 | 融解曲線 |
| 95℃、30秒 | 変性:95℃、5秒 アニーリング:55℃、30秒 伸長反応:72℃、30秒 |
Start:60℃ End:95℃ |
- 初期変性
初期変性は通常95℃、30秒で充分である。環状プラスミドやゲノムDNAなど変性しにくい鋳型でも、ほとんどの場合、この条件で良好に反応できる。鋳型の状態によっては、95℃、1~2分程度に延長することが可能であるが、時間が長すぎると酵素の失活を招く恐れがあるため、2分以上の条件は推奨しない。 - PCRの変性ステップ
リアルタイムPCRのターゲットの増幅サイズは通常300 bp以下なので、5秒程度でよい。 - アニーリングおよび伸長反応ステップ
・反応特異性を上げるには、アニーリング温度を上げるか、2 step PCRに変更する。増幅効率とのバランスを確認しながら、検討を行う。
・増幅効率を上げたい場合は、伸長時間を延ばすか、3 step PCRに変更することにより改善することがある。反応特異性とのバランスを確認しながら検討する。 - サイクル数
最初に40サイクルで検討し、必要に応じてサイクル数を増減する。
(2) 検出ステップ(ターゲット特異的検出)
通常、2 step PCRではアニーリング/伸長反応ステップで、3 step PCRでは伸長ステップで蛍光の検出を行う。
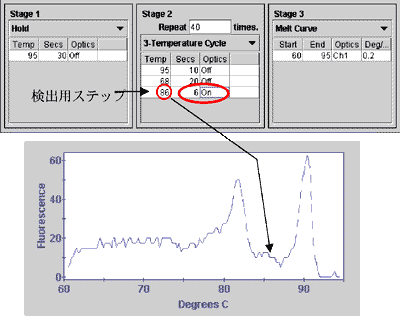
単一な増幅はできないが、副産物のTm値がターゲットのTm値よりも充分に低い場合(融解曲線の負の一次微分曲線(-dF/dT)で各Tm値のピークが独立している場合)には、副産物を除いてターゲットだけを特異的に検出することが可能である。伸長反応のステップで蛍光シグナルを検出すると、ターゲットも副産物もすべて二本鎖の状態を保ち、蛍光を発する。そこで副産物が解離してしまう温度で検出を行えば、ターゲットに由来する蛍光シグナルのみを検出することができる。
検出ステップ:伸長反応ステップの次に検出用のステップを作成する(2ステップPCRであれば全部で3ステップに、3ステップPCRであれば4ステップになる)。
検出温度:融解曲線の負の一次微分曲線(-dF/dT)でターゲットと副産物のピークの谷間部分の温度を検出温度として設定する(図4)。
検出ステップの時間:6秒(検出器の動作に6秒必要なため)。
3. 濃度依存的な増幅曲線の立ち上がりを確認
-鋳型の希釈系列を作成して濃度依存的に増幅曲線が立ち上がるかどうかを調べる-(1) 希釈系列の作成
サンプル:total RNAから調製したcDNA、増幅するターゲット配列を含むPCR産物、あるいはそれをプラスミドにクローニングしたもの
濃度:5~10倍ずつの希釈系列を調製する。cDNAの場合は、total RNA 1 pg~100 ng相当、コピー数が概算できるプラスミドなどの場合は101~1010コピーの範囲内で作製する。
(2) リアルタイムPCR装置のソフトウエアの設定
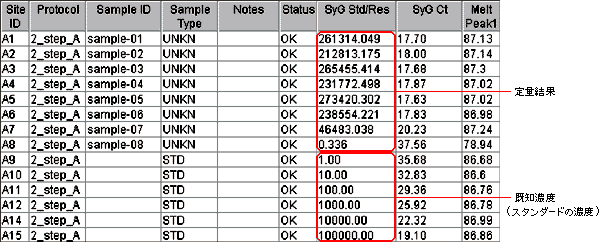
各装置の説明書に従って操作を行う。下記にはSmart Cyclerの例を示す。Results tableのSample TypeでSTDを選択し、各サンプルの濃度(コピー数など)をSyG Std/Resのカラムへ入力する(図5)。
(3) 検量線の作成
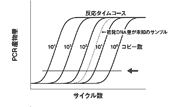
各濃度のサンプルについて、リアルタイムPCRを行い、検量線を作成し、その直線性と傾きを調べる(図6)。
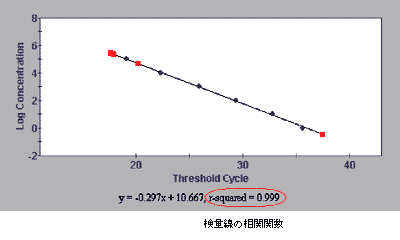
≪信頼性の高い検量線の条件≫
Smart Cyclerでの傾きとPCR効率は、以下のような関係になります。PCR効率で80~100%にするなら、傾きは-0.225~-0.301となります。
-0.25: 77.8%
-0.33: 113.8%
-0.255: 80%
-0.301: 100%
検量線は、直線性と同時に傾きも適正範囲であることが重要である。適正範囲を大きくはずれている場合は、検量線の信頼性が低くなる。良い結果が得られない場合は、先に述べた条件についてもう一度検討する。それでも良くならない場合は、プライマーの設計から見直すことになる。
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。