- 目的遺伝子とマーカー遺伝子(あるいは2つの目的遺伝子)を、IRESを介して単一mRNAから翻訳
- 薬剤耐性マーカーあるいは蛍光タンパク質マーカーにより、目的タンパク質高発現細胞を速やかに特定
- バイシストロニックな発現により、安定クローンを迅速かつ確実に選択可能
| 注意: | pIRES Vector(製品コード 631605)、pEF1α-IRES Vector(製品コード 631970)は、IRES下流の遺伝子の発現が弱いため、抗生物質耐性遺伝子以外の遺伝子(蛍光タンパク質など)の発現には適していません。任意の2つの遺伝子を構成的に発現させたい場合はバイディレクショナル発現ベクターの使用をお勧めします。 |
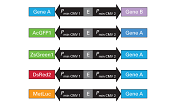
pIRES Bicistronic Expression Vectorを使用すると、目的遺伝子が発現する細胞を短時間で効率よく選択できる。本ベクターでは目的遺伝子と選択マーカー遺伝子(薬剤耐性マーカー:図1、蛍光タンパク質マーカー:図2)は同一プロモーター下で発現する。マーカー遺伝子が目的遺伝子と単一mRNAから翻訳されるため、選択マーカーを発現する細胞のほぼすべてが目的遺伝子も発現している。本ベクターの利用により、最小限のスクリーニングで目的遺伝子高発現株が得られる。
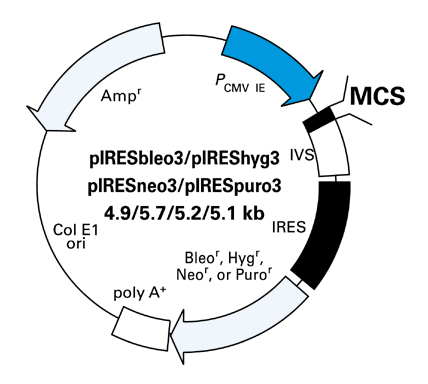
図1. 薬剤耐性マーカー搭載IRESベクター
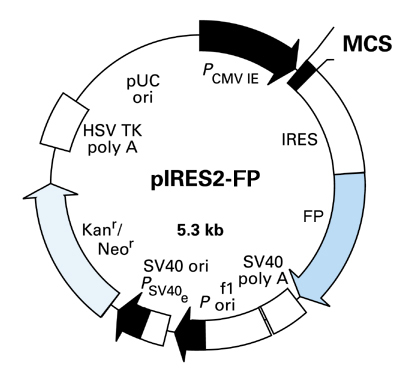
図2. 蛍光タンパク質搭載IRES2ベクター
FP:AcGFP1、DsRed-Express、またはZsGreen1

図1. 薬剤耐性マーカー搭載IRESベクター

図2. 蛍光タンパク質搭載IRES2ベクター
FP:AcGFP1、DsRed-Express、またはZsGreen1
Living Colors pIRES2 Vectorは目的遺伝子とマーカー遺伝子を同等に発現
pIRES2-蛍光タンパク質ベクターのIRES2配列は、本来のIRES配列を有するため、IRES2下流に搭載される蛍光タンパク質マーカーは従来のIRESベクター(一部の配列を欠損したIRES配列を使用)に搭載された場合よりも高い発現を示す。マーカーは融合タンパク質として発現するのではなく、個別に発現するため、目的タンパク質の生物活性が影響を受けるリスクはほとんどない。pIRES2ベクターは一過性に遺伝子導入した細胞集団を濃縮する場合や蛍光強度により目的タンパク質の発現レベルをモニターする場合にも便利である。
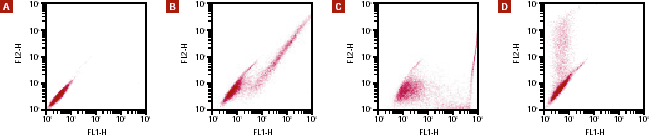
図4. pIRES2-ZsGreen1 VectorのIRESを介した同時発現をフローサイトメトリーにて確認
pIRES2-ZsGreen1 VectorのマルチクローニングサイトにDsRed-Expressタンパク質をコードする遺伝子を組み込み、細胞に導入した。
パネルA:トランスフェクションしていないコントロール細胞
パネルB:トランスフェクションされた細胞は対角線上に分布し、ZsGreen1とDsRed-Express蛍光タンパク質を同時に発現していることが確認できる。
パネルC:ZsGreen1タンパク質のみを発現するコントロール細胞は、FL-1チャンネルでのみ検出され、X軸に沿って分布が見られた。
パネルD:別途用意したDsRed-Expressタンパク質のみを発現する細胞は、FL-2チャンネルでのみ検出され、Y軸に沿って分布が見られた。
各サンプルの解析は、波長488 nmのレーザー光を用い、FACSCalibur Flow Cytometerで行った。
| 注意: | IRES配列上流のMCSに翻訳されるORFをクローニングしていない状態では、蛍光タンパク質の発現が弱く、蛍光顕微鏡による検出が難しい場合がある。IRES前のMCSに約0.7~1.2 kbの遺伝子を挿入して使用することをお勧めする。 |

図4. pIRES2-ZsGreen1 VectorのIRESを介した同時発現をフローサイトメトリーにて確認
pIRES2-ZsGreen1 VectorのマルチクローニングサイトにDsRed-Expressタンパク質をコードする遺伝子を組み込み、細胞に導入した。
パネルA:トランスフェクションしていないコントロール細胞
パネルB:トランスフェクションされた細胞は対角線上に分布し、ZsGreen1とDsRed-Express蛍光タンパク質を同時に発現していることが確認できる。
パネルC:ZsGreen1タンパク質のみを発現するコントロール細胞は、FL-1チャンネルでのみ検出され、X軸に沿って分布が見られた。
パネルD:別途用意したDsRed-Expressタンパク質のみを発現する細胞は、FL-2チャンネルでのみ検出され、Y軸に沿って分布が見られた。
各サンプルの解析は、波長488 nmのレーザー光を用い、FACSCalibur Flow Cytometerで行った。
その他のIRESベクター
pIRES Vectorは、IRESを介して2種類の目的遺伝子を同時に発現するためのベクターである。pEXP-Lib Vectorは哺乳類細胞でcDNAライブラリーを発現するために使用する。遺伝子導入が難しい細胞に目的遺伝子と蛍光タンパク質マーカーを導入するための2種類のレトロウイルス発現用IRESベクターも用意している。IRESを介して遺伝子が同時に発現
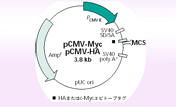
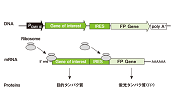
pIRESベクターには、脳心筋炎ウイルス(ECMV)のIRES(mRNA内部のリボソーム進入サイト)が含まれており、1種類のmRNAから2ヵ所のオープンリーディングフレーム(ORF)を翻訳することができる(1、2)。リボソームは、バイシストロン性mRNAの5’末端から目的遺伝子を翻訳するだけでなく、ECMV IRESの位置にも結合し、薬剤耐性あるいは蛍光タンパク質マーカー遺伝子を翻訳する(図3)。薬剤耐性マーカーを搭載したpIRES Antibiotic Selection Vectorでは、部分的に不活性化したIRESを使用しているため、選択マーカー遺伝子の翻訳効率は目的遺伝子より低く、目的タンパク質を高レベルに発現する細胞を優先的に選択可能である(3)。
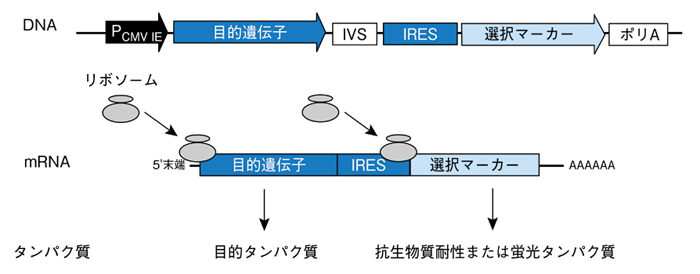
図3. バイシストロン性mRNA翻訳の概略図
IRES(mRNA内部のリボソーム進入サイト)によって、目的遺伝子は抗生物質耐性タンパク質あるいは蛍光タンパク質と共に同一のmRNAから翻訳される。
IVS=合成イントロン

図3. バイシストロン性mRNA翻訳の概略図
IRES(mRNA内部のリボソーム進入サイト)によって、目的遺伝子は抗生物質耐性タンパク質あるいは蛍光タンパク質と共に同一のmRNAから翻訳される。
IVS=合成イントロン
保存
-20℃
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。