高力価レンチウイルスを調製するためのパッケージング試薬【Lentiviral High Titer Packaging Mix】とレンチウイルス産生用のトランスフェクション試薬【TransIT-Lenti Transfection Reagent】をセットでご使用いただいた評価結果をご紹介します。
今後も継続して評価結果を追加していきます!
TransIT-Lenti Transfection Reagentの
無料サンプルのお申込みはこちら★
今後も継続して評価結果を追加していきます!
TransIT-Lenti Transfection Reagentの
無料サンプルのお申込みはこちら★
-
A研究所 S様
- Q1. 実験の概要を簡単に教えてください
- CRISPR-Cas9システムを用いたノックアウト細胞を作製するため、D社ベクターにガイド配列を挿入し、それをレンチウイルスで発現させるよう実験系を組んだ。Lentiviral High Titer Packaging Mix(製品コード 6194)を用いて、HEK293T細胞の培養上清からレンチウイルスを回収した。このウイルスをヒト中皮細胞であるMeT-5A細胞に感染させて感染効率を算出した。
- Q2. 導入した細胞は?
- MeT-5A
- Q3. 比較実験に用いた試薬は?
-
D社ベクター
D社パッケージングミックス試薬
F社トランスフェクション試薬 - Q4. 使ってみた感想や評価結果をお願いします
- ラボ内プロトコールを用いたこれまでの結果と比較して約2倍のタイターが得られました。今後はこのキットを用いてCRISPRライブラリーの作製を行いたいと思います。ありがとうございました。
-
N大学 T様
- Q1. 実験の概要を簡単に教えてください
- タカラバイオのLentiviral High Titer Packaging Mix(製品コード 6194)を用いた場合に従来の方法と比較して、ウイルス力価に差異が見られるかをGFPの発現で比較した。
- Q2. 導入した細胞は?
- レンチウイルス産生のためのトランスフェクション用細胞:HEK293
各種条件で作製したレンチウイルスを感染させた細胞:HEK293 および HepG2 - Q3. 比較実験に用いた試薬は?
-
条件1 条件2 条件3 条件4 レンチウイルスベクタープラスミド H社ベクター/GFP パッケージングプラスミド H社パッケージングミックス試薬 Lentiviral High Titer Packaging Mix(製品コード 6194) H社パッケージングミックス試薬 Lentiviral High Titer Packaging Mix(製品コード 6194) 遺伝子導入試薬 B社トランスフェクション試薬 感染細胞 HEK293 HepG2 - Q4. 使ってみた感想や評価結果をお願いします
-
【結果】
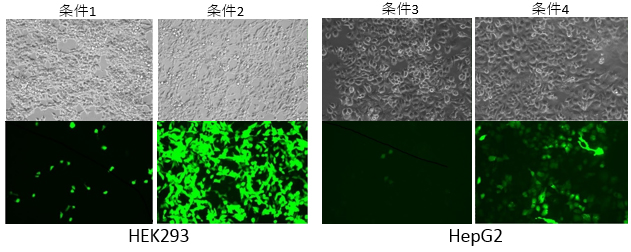
【感想】
Lentiviral High Titer Packaging Mix(製品コード 6194)は現在用いているH社のものと比べ、かなり良い結果となり、感染効率および発現量の高いLentivirusを取得することができました。素晴らしいです!
-
K大学 S様
- Q1. 実験の概要を簡単に教えてください
- A研究所が提供しているパッケージングプラスミドを利用した場合と、タカラバイオのLentiviral High Titer Packaging Mixを利用した場合で、得られたウイルス力価に差異が見られるかをGFPの発現強度を比較することで検証した。
- Q2. 導入した細胞は?
- SH-SY5Y細胞を利用した。SH-SY5Y細胞は通常のプラスミドベクターを利用しても一過性発現株や安定発現株を作製すること自体は可能だが、遺伝子導入効率が低く、また得られた細胞での発現量も必ずしも高くなく、我々の研究室ではレンチウイルスを利用した実験系を樹立しているところである。
- Q3. 比較実験に用いた試薬は?
-
*1 ネガティブコントロール(無処理の細胞)条件1*1 条件2 条件3*2 レンチウイルスベクタープラスミド - A研究所ベクター/GFP パッケージングプラスミド - Lentiviral High Titer Packaging Mix(製品コード 6194) A研究所パッケージングプラスミド 遺伝子導入試薬 - TransIT-Lenti Transfection Reagent(製品コード MIR6603)
*2 A研究所の推奨プロトコールで実施 - Q4. 使ってみた感想や評価結果をお願いします
-
【結果】
GFPの発現をFlow cytometerで確認した。Lentiviral High Titer Packaging Mixを利用した場合、A研究所から提供を受けたパッケージングプラスミドを利用したサンプルと比較して、GFPの発現強度が全体に強い上に、ほぼすべての細胞がGFP陽性であった。すなわち、Lentiviral High Titer Packaging Mixを利用すると、より高い力価のウイルス液を得ることができると考えられた。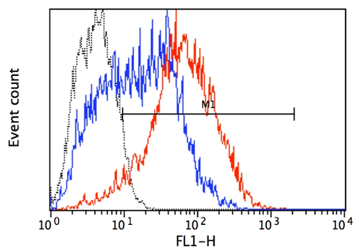
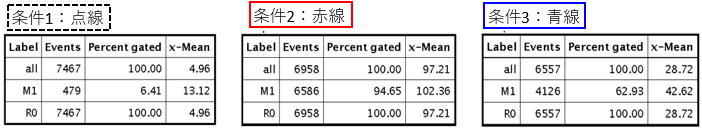 【感想】
【感想】
Lentiviral High Titer Packaging MixはA研究所のパッケージングプラスミドと比べてX-meanが約3倍で、GPF陽性細胞数の割合も約1.5倍であった。GFP陽性細胞数の割合が高く、かつより発現強度が強い細胞集団を得ることができるので、極めて有用な試薬だと感じた。
-
K大学 I様
- Q1. 実験の概要を簡単に教えてください
- HeLa細胞にGFP-チューブリンを発現させるためのレンチウイルス作製を行った。
- Q2. 導入した細胞は?
- レンチウイルス作製にはB社製293FT細胞を用いた。
作製したレンチウイルスをHeLa細胞に感染させた。 - Q3. 比較実験に用いた試薬は?
-
以下の3通りの組み合わせでレンチウイルスを作製した。
なお作製したレンチウイルスは全てLenti-X Concentrator(製品コード 631231)を用いて100倍濃縮した。条件1 条件2 条件3 レンチウイルスベクタープラスミド B社ベクター/AcGFP-tubulin(5 μg) パッケージングプラスミド B社パッケージング試薬(5 μg) Lentiviral High Titer Packaging Mix(製品コード 6194) 遺伝子導入試薬 B社 TransIT-Lenti Transfection Reagent(製品コード MIR6600) - Q4. 使ってみた感想や評価結果をお願いします
-
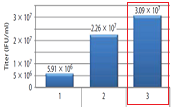
【方法と結果】
上記3通りの組み合わせで作製/濃縮したレンチウイルスストック液の段階希釈系列を作製して,polybrene法にてHeLa細胞に感染させた。
Blasticidinにて9日間選択をした後に,クリスタルバイオレット染色してコロニー数をカウントした。
算出したトランスダクションユニット(TU/ml)を以下に示す。
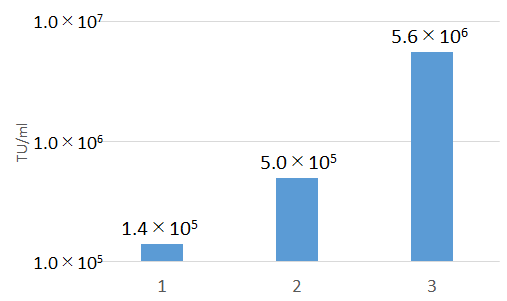
【使用した感想】
今回は同一のウイルスベクターを用いてパッケージング試薬をLentiviral High Titer Packaging Mixに置き換えることの効果を検証した。結果、B社のパッケージング試薬をLentiviral High Titer Packaging Mixに換えるだけで顕著な力価の向上が認められた。このことは、既にB社のシステムでレンチ作製系を確立している研究室でもLentiviral High Titer Packaging Mixを追加で導入するメリットが充分にあることを示す。
また予想外であったのが、B社のトランスフェクション試薬をTransIT-Lenti Transfection Reagentに置き換えるだけでも3.5倍程度の向上が認められた。そのため、Lentiviral High Titer Packaging MixとTransIT-Lenti Transfection Reagentはセットで使用することが好ましいと予想される。
-
T大学 K様
- Q1. 実験の概要を簡単に教えてください
- 免疫系細胞においてレンチウイルスを用いて実際に遺伝子導入出来るか、条件検討を行った。
- Q2. 導入した細胞は?
- HEK293細胞、RAW264.7細胞
- Q3. 比較実験に用いた試薬は?
-
パッケージングプラスミド:C大学より供与
ベクター:pLVSIN-CMV-GFP
トランスフェクション試薬:A社製品 - Q4. 使ってみた感想や評価結果をお願いします
-
パッケージングプラスミド(C大学より供与)とトランスフェクション試薬(B社製品)を用いて調製したウイルスは、HEK293には8割方導入されたが、RAW264.7には導入されなかった。
一方、Lentiviral High Titer Packaging Mix(製品コード 6194)とTransIT-Lenti Transfection Reagent(製品コード MIR6600)を用いると、HEK293に同様の8割方導入され、かつRAW264.7には1~2割導入された。
もともと免疫細胞系は遺伝子導入が難しいのであるが、0から1~2割はかなりのアドバンテージであると考える。
-
J大学 N様
- Q1. 実験の概要を簡単に教えてください
- EGFPをマウス線維芽細胞に発現させた。
- Q2. 導入した細胞は?
- マウス線維芽細胞
- Q3. 比較実験に用いた試薬は?
-
パッケージングプラスミド:D社製品
ベクター:pLVSIN-EF1alpha-Puro(製品コード 6186)
トランスフェクション試薬:B社製品 - Q4. 使ってみた感想や評価結果をお願いします
- パッケージングプラスミド(D社製品)とトランスフェクション試薬(B社製品)を用いて調製したウイルスおよびLentiviral High Titer Packaging Mix(製品コード 6194)とTransIT-Lenti Transfection Reagent(製品コード MIR6600)を用いて調製したウイルスの目的細胞での発現は、ほぼ同等であり問題なく実験できました。
この製品を見た人は、
こんな製品も見ています
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。