リンパ球の遺伝子導入と拡大培養を低コストで効率的に!
- レンチウイルスベクターやレトロウイルスベクターを利用した遺伝子導入の効率化を向上
- T細胞培養時にナイーブT細胞を高い割合で含む細胞集団を取得可能
- ガス透過性容器(G-Rexシリーズ)用のプロトコールにより遺伝子導入・拡大培養を迅速・簡便に実施
製品説明
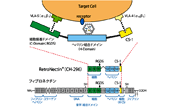
RetroNectin Pro (Recombinant Human Fibronectin Fragment) は、ヒトフィブロネクチンの細胞接着ドメイン(C-domain)、ヘパリン結合ドメイン(H-domain)、CS-1部位(図1)の3種類の機能性ドメインを含む組換えタンパク質*1であり、レトロウイルスベクターやレンチウイルスベクターによる哺乳類細胞への遺伝子導入を促進します。VLA-4を発現する細胞はCS-1部位と、VLA-5を発現する細胞は細胞接着ドメイン(C-domain:RGDS配列)と接着し、また、ウイルスベクターはヘパリン結合ドメイン(Type III repeat, 12, 13, 14)に結合することによって、局所的にターゲット細胞とウイルスベクターの濃度が高められ、遺伝子導入が促進されると考えられます。
さらに、RetroNectin ProはT細胞の増殖培養において、インターロイキン-2(IL-2)等のサイトカインの存在下で抗CD3抗体(製品コード T210)との共刺激を行うことで、増殖したT細胞は高い割合でナイーブT細胞*2を含む特徴があります。
T細胞の拡大培養にはガス透過性容器(G-Rexシリーズ)などが使用されていますが、レンチウイルベクターやレトロウイルスベクターの遺伝子導入とその後の拡大培養を同時に実施可能なプロトコールにより、作業効率を大幅に向上させたコストパフォーマンスの高い実験が可能です。
*1 分子量62,617 Da(アミノ酸配列より)
*2 抗原提示を受け細胞傷害性T細胞に分化する能力をもつ細胞

図1.フィブロネクチンとレトロネクチンの構造およびレトロネクチンでの遺伝子導入のモデル図
さらに、RetroNectin ProはT細胞の増殖培養において、インターロイキン-2(IL-2)等のサイトカインの存在下で抗CD3抗体(製品コード T210)との共刺激を行うことで、増殖したT細胞は高い割合でナイーブT細胞*2を含む特徴があります。
T細胞の拡大培養にはガス透過性容器(G-Rexシリーズ)などが使用されていますが、レンチウイルベクターやレトロウイルスベクターの遺伝子導入とその後の拡大培養を同時に実施可能なプロトコールにより、作業効率を大幅に向上させたコストパフォーマンスの高い実験が可能です。
*1 分子量62,617 Da(アミノ酸配列より)
*2 抗原提示を受け細胞傷害性T細胞に分化する能力をもつ細胞

図1.フィブロネクチンとレトロネクチンの構造およびレトロネクチンでの遺伝子導入のモデル図
ガス透過性培養容器(G-Rex 24 well plate)を用いたT細胞への遺伝子導入と拡大培養
ガス透過性培養容器(G-Rexシリーズ)は、高密度培養が可能であり細胞の拡大培養時によく使用されています。
レンチウイルスベクター等によるT細胞の遺伝子導入操作を行う場合、図2に示す一般的な使用法のように、T細胞の活性化から遺伝子導入までをプレート等で行い、その後、細胞をG-Rexに移し拡大培養が行われています(参考文献)。
本試験では、RetroNectinと抗CD3抗体をG-Rex容器に直接コーティングし、遺伝子導入と拡大培養を同じG-Rex容器で行う方法を実施し、遺伝子導入効率とナイーブT細胞の増殖効果について検証しました。
参考文献:
Mapping variant effects on anti-tumor hallmarks of primary human T cells with base-editing screens
Zachary H.Walsh, Parin Shah, Neeharika Kothapalli, et al., Nature Biotechnology (2024)
https://doi.org/10.1038/s41587-024-02235-x

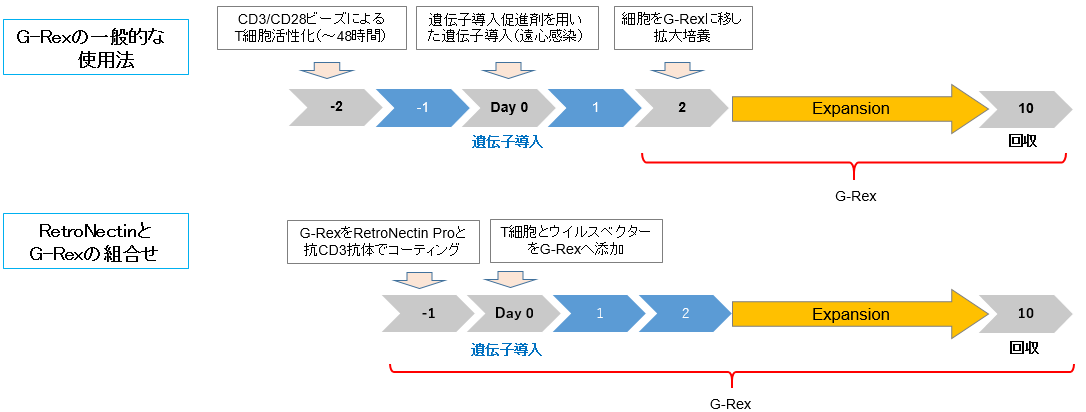 図2.G-Rex 24 well plateでの遺伝子導入と拡大培養のフロー
図2.G-Rex 24 well plateでの遺伝子導入と拡大培養のフロー
実験条件Bは、レトロネクチンを使用しない比較対象として試験を実施した。
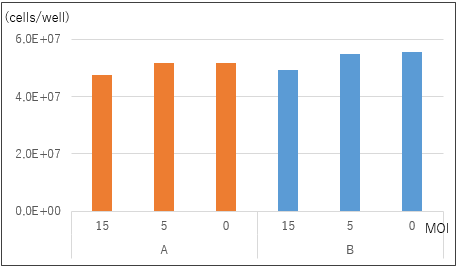
図3. 拡大培養後の細胞数
10日間培養した細胞の1ウェル (2 cm2)当たりの細胞数を示す。
G-Rex容器を用いることにより、A、Bどちらの条件でも高密度で(1 cm2当たり2×107 cells以上)培養できることが確認できた。
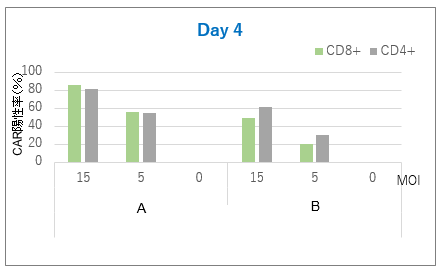
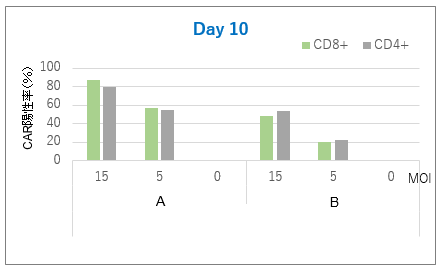
図4. 遺伝子導入効率
トランスダクション後、Day4、Day10にサンプリングした細胞のCAR陽性率を解析した。
その結果、RetroNectin処理条件(A)においては、遺伝子導入効率が高く、CAR陽性率の高い細胞が得られたことが確認できた。
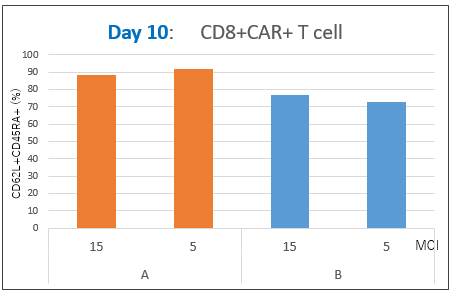
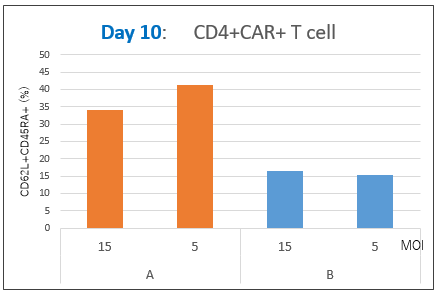
図5. ナイーブT細胞比率
Day10で回収した細胞について、ナイーブT細胞比率を解析した。その結果、CD8+CAR+およびCD4+CAR+細胞中のナイーブT細胞比率は、MOI(5および15)にかかわらず、RetroNectin処理条件(A)の方が高いことが確認できた。
以上より、G-RexにRetroNectinと抗CD3抗体をコーティングすることで、一つの容器内で(1)ウイルスベクターによる遺伝子導入と(2)拡大培養を行うことができ、高い遺伝子導入効率とナイーブT細胞を多く含む細胞を取得することができた。
G-Rexは培養スケールに応じてスケールアップが容易なシステムであり、RetroNectinを組み合わせることで、作業効率を大幅に向上させたコストパフォーマンスの高い試験を実施することが可能であることが示された。
レンチウイルスベクター等によるT細胞の遺伝子導入操作を行う場合、図2に示す一般的な使用法のように、T細胞の活性化から遺伝子導入までをプレート等で行い、その後、細胞をG-Rexに移し拡大培養が行われています(参考文献)。
本試験では、RetroNectinと抗CD3抗体をG-Rex容器に直接コーティングし、遺伝子導入と拡大培養を同じG-Rex容器で行う方法を実施し、遺伝子導入効率とナイーブT細胞の増殖効果について検証しました。
参考文献:
Mapping variant effects on anti-tumor hallmarks of primary human T cells with base-editing screens
Zachary H.Walsh, Parin Shah, Neeharika Kothapalli, et al., Nature Biotechnology (2024)
https://doi.org/10.1038/s41587-024-02235-x

| 実験条件 | A | B |
| プレートコーティング | RetroNectin Proと抗CD3抗体(製品コード T210)を4℃、O/N静置後、除去・洗浄。 | - |
| T細胞の活性化 | RetroNectin Proと抗CD3抗体(製品コード T210)のプレートコーティングにより実施。 | CD3/CD28 beads(他社製) |
| 細胞 | CD8陽性およびCD4陽性 T細胞 | |
| セットアップ時の細胞数 | 1×106 cells | |
| セットアップ時の総液量 | 1.0 ml | |
| トランスダクション実施日 | Day 0 | |
| レンチウイルスベクター | CD19-CAR遺伝子搭載レンチウイルスベクターをMOI(多重感染度)15、5で感染 | |
| 培養用培地 | LymphoONE T-Cell Expansion Xeno-Free Medium, 1L Bottle(製品コード WK552S)にヒト血清アルブミン、IL2を添加 | |
結果

図3. 拡大培養後の細胞数
10日間培養した細胞の1ウェル (2 cm2)当たりの細胞数を示す。
G-Rex容器を用いることにより、A、Bどちらの条件でも高密度で(1 cm2当たり2×107 cells以上)培養できることが確認できた。


図4. 遺伝子導入効率
トランスダクション後、Day4、Day10にサンプリングした細胞のCAR陽性率を解析した。
その結果、RetroNectin処理条件(A)においては、遺伝子導入効率が高く、CAR陽性率の高い細胞が得られたことが確認できた。


図5. ナイーブT細胞比率
Day10で回収した細胞について、ナイーブT細胞比率を解析した。その結果、CD8+CAR+およびCD4+CAR+細胞中のナイーブT細胞比率は、MOI(5および15)にかかわらず、RetroNectin処理条件(A)の方が高いことが確認できた。
以上より、G-RexにRetroNectinと抗CD3抗体をコーティングすることで、一つの容器内で(1)ウイルスベクターによる遺伝子導入と(2)拡大培養を行うことができ、高い遺伝子導入効率とナイーブT細胞を多く含む細胞を取得することができた。
G-Rexは培養スケールに応じてスケールアップが容易なシステムであり、RetroNectinを組み合わせることで、作業効率を大幅に向上させたコストパフォーマンスの高い試験を実施することが可能であることが示された。
内容
RetroNectin Pro 0.5 mg(0.5 ml)(製品コード T101A)
RetroNectin Pro 2.5 mg(2.5 ml)(製品コード T101B)
本製品は溶液品(ろ過滅菌処理済)(1 mg/ml)である。
(形状)12.5 mM クエン酸ナトリウム(pH6.2)、1.25% ショ糖(Sucrose)
RetroNectin Pro 2.5 mg(2.5 ml)(製品コード T101B)
本製品は溶液品(ろ過滅菌処理済)(1 mg/ml)である。
(形状)12.5 mM クエン酸ナトリウム(pH6.2)、1.25% ショ糖(Sucrose)
保存
-20℃
起源
E. coli expressing human fibronectin fragment CH-296
濃度
1 μg/μl
分子量
62,617 Da(アミノ酸配列より)
純度
HPLCにて純度90%以上。
使用上の注意
- 無菌的な環境下で作業してください。
- 凍結融解の繰り返しは、10回程度まで可能です。
- ボルテックスによる撹拌は避けてください。
- レトロネクチンが吸着する恐れがあるため、PBSで希釈したRetroNectin溶液は、フィルター滅菌しないでください。
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。