製品説明
RHB-A培地は上皮増殖因子(EGF)や線維芽細胞増殖因子-2(FGF-2)を添加して使用することにより、無血清で接着培養状態の神経幹(NS)細胞の維持や拡大培養に使用できる。(参考文献1-4, 8)
増殖因子を含む本培地で神経幹(NS)細胞を培養することにより 二倍体の核型を維持した状態で、100世代を超えて神経原性能を維持できることが示された。また、EGFやFGF-2を加えて、クローン原性の神経幹(NS)細胞の誘導にも使用できる。
EGFやFGF-2を加えて、グリオーマ神経幹(NS)細胞株の増殖にも使用できる報告もある。(参考文献5)
マウスES細胞の神経細胞への分化には、増殖因子を加えずにRHB-Aを使用する。NDiff 227(製品コード Y40002)よりも効果的に分化が促進される。(参考文献6, 7)
また、増殖因子を加えずに本培地で神経幹(NS)細胞を接着培養すると、神経細胞に機能的に分化することができる。(参考文献1)
In vitroでのヒト脳の器官初代培養において放射状グリア由来の神経幹(NS)細胞の拡大培養、分化にも使用できる。(参考文献8)
増殖因子を含む本培地で神経幹(NS)細胞を培養することにより 二倍体の核型を維持した状態で、100世代を超えて神経原性能を維持できることが示された。また、EGFやFGF-2を加えて、クローン原性の神経幹(NS)細胞の誘導にも使用できる。
EGFやFGF-2を加えて、グリオーマ神経幹(NS)細胞株の増殖にも使用できる報告もある。(参考文献5)
マウスES細胞の神経細胞への分化には、増殖因子を加えずにRHB-Aを使用する。NDiff 227(製品コード Y40002)よりも効果的に分化が促進される。(参考文献6, 7)
また、増殖因子を加えずに本培地で神経幹(NS)細胞を接着培養すると、神経細胞に機能的に分化することができる。(参考文献1)
In vitroでのヒト脳の器官初代培養において放射状グリア由来の神経幹(NS)細胞の拡大培養、分化にも使用できる。(参考文献8)
保存
-20℃
融解後は、4℃で保存し、4週間以内に使用する。
必ず遮光して保存すること。
融解後は、4℃で保存し、4週間以内に使用する。
必ず遮光して保存すること。
用途
●マウス・ヒト神経幹(NS)細胞の接着培養での維持、拡大培養
●マウスES細胞の単層培養での神経分化
●マウスES細胞、胎児、成体組織からの神経幹(NS)細胞の誘導
●マウス・ヒト神経幹(NS)細胞の神経細胞への分化
●ヒトグリオブラストーマ幹細胞株の維持、拡大培養
●マウスES細胞の単層培養での神経分化
●マウスES細胞、胎児、成体組織からの神経幹(NS)細胞の誘導
●マウス・ヒト神経幹(NS)細胞の神経細胞への分化
●ヒトグリオブラストーマ幹細胞株の維持、拡大培養
アプリケーションデータ
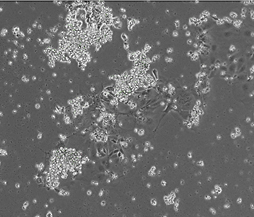
(A)Day 6
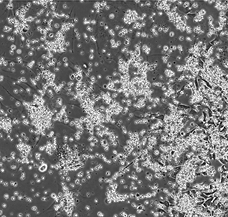
(B)Day 9
B6ES細胞(自作、NHB6Xn1)について、RHB-A培地を用いて神経細胞へ分化誘導させた。Day 6およびDay 9でそれぞれ顕微鏡観察を行った。Day 6(A)の段階で既に分化が進んでいる構造がみられ、Day 9(B)では成熟した軸索がはっきりと確認できるようになった。
(データのご提供:富山大学 研究推進機構 研究推進総合支援センター 西園 啓文 先生)
使用方法
ヒト・マウス神経幹(NS)細胞の維持:
RHB-AにEGFおよびFGF-2を添加して使用する。(製品にはEGFおよびFGF-2は含まれていない。)EGFおよびFGF-2の推奨添加濃度は、10~20 ng/mlである。(実験条件により最適化する必要がある。)
培地は、2~3日ごとに交換する。
Nestin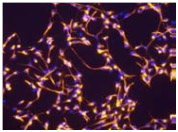 | Vimentin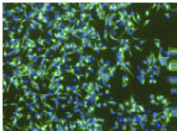 |
|---|---|
3CB2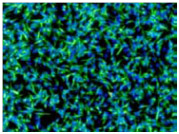 | Map 2 |
| マウスNS細胞 | |
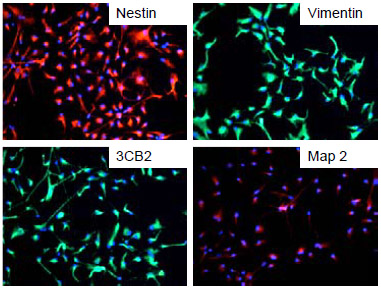
ヒトNS細胞
図1. RHB-A(EGFおよびFGF-2を添加)で培養したマウス神経幹細胞およびヒト神経幹細胞の神経マーカー発現の確認
ヒト・マウス神経幹(NS)細胞の神経細胞への分化:
維持培地からEGFおよびFGF-2を段階的に除き、適当な試薬を添加することにより分化誘導を行う(参考文献9)。(製品にはEGFおよびFGF-2は含まれていない。)
培地は2~3日毎に交換する。細胞播種密度は細胞株により最適化する必要がある。
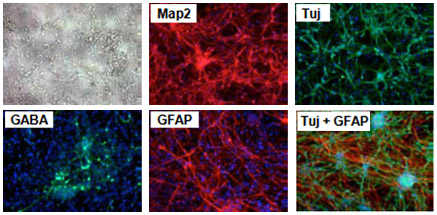
図2. 分化後のヒト神経細胞における神経マーカーの発現確認
マウスES細胞の神経前駆細胞への分化:
- フィーダーフリーの継代数の低いES細胞を0.5~2×104 cells/cm2の密度でゼラチンコートのプレート*にRHB-A培地を用いて播種する。
- 1~2日ごとに培地を交換する。神経細胞への分化の初期段階でかなりの数の死細胞が観察される。
- 神経細胞への分化を形態観察、またマーカーの発現などで観察する神経細胞への分化は、4~6日目から観察され、7~9日目にニューロン成熟が見られる。
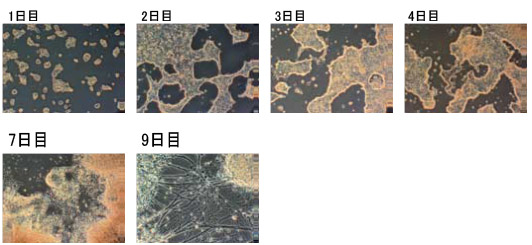
図3. マウスES細胞の単層培養による神経分化の様子
使用文献
-
Veliparib in combination with radiotherapy for the treatment of MGMT unmethylated glioblastoma
Jue TR et al. (2017) Mar; J. Transl. Med. 15(1) doi:10.1186/s12967-017-1164-1. -
Combination of palbociclib and radiotherapy for glioblastoma
Whittaker S et al. (2017) Jul; Cell. Death. Descov. 3 doi: 10.1038/cddiscovery.2017.33.
参考文献
- Long‐term tripotent differentiation capacity of human neural stem (NS) cells in adherent culture. Molecular and Cellular.
Sun Y, Pollard S, Conti L, Toselli M, Biella G, Parkin G, Willatt L, Falk A, Cattaneo E, Smith A (2008) Neuroscience 38:245-258. - Niche‐Independent symmetrical selfrenewal of a mammalian tissue stem cell.
Conti L, Pollard SM, Gorba T, Reitano E, Toselli M, Biella G, Sun Y, Sanzone S, Ying QL, Cattaneo E, Smith A (2005) PLoS Biology 3(9): e283 - Adherent Neural Stem (NS) cells from fetal and adult forebrain.
Pollard SM, Conti L, Sun Y, Goffredo D, Smith A (2006) Cerebral Cortex 16:112-120. - Fibroblast growth factor induces a neural stem cell phenotype in foetal forebrain progenitors and during embryonic stem cell differentiation.
Pollard SM, Wallbank R, Tomlinson S, Grotewold L, Smith A (2008) Molecular and Cellular Neuroscience 38:393-403. - Glioma stem cell lines expanded in adherent culture have tumor‐specific phenotypes and are suitable for chemical and genetic screens.
Pollard SM, Yoshikawi K, Clarke ID, Danovi D, Stricker S, Russell R, Bayani J, Head R, Lee M, Bernstein M, Squire J, Smith A, Dirks P (2009). Cell Stem Cell 4:568-580. - Optimization and integration of expansion and neural commitment of mouse embryonic stem cells.
Diogo MM, Henrique D, Cabral JM (2008) Biotechnology and Applied Biochemistry 49:105-112. - Neural differentiation of embryonic stem cells in vitro: A road map to neurogenesis in the embryo.
Abranches E, Silva M, Pradier L, Schulz H, Hummel O, Henrique D, Bekman E (2009) PLoS ONE 4 (7): e6286 - Neurogenic radial glia in the outer subventricular zone of human neocortex.
Hansen DV, Lui JH, Parker PRL, Kriegstein AR (2010) Nature 464(7288):554-561. - Non-immortalized human neural stem (NS) cells as a scalable platform for cellular assays.
Hook L, Vives J, Fulton N, Leveridge M, Lingard S, Bootman MD, Falk A, Pollard SM, Allsopp TE, Dalma-Weiszhausz D, Tsukamoto A, Uchida N, Gorba T. Neurochem Int. (2011) Sep;59(3):432-444.
関連のオンラインガイド、資料はこちら
幹細胞・再生医療研究ガイド
タカラバイオで展開している幹細胞研究のための試薬・受託サービス選択ガイドの他、関連情報をまとめています。
タカラバイオで展開している幹細胞研究のための試薬・受託サービス選択ガイドの他、関連情報をまとめています。
この製品を見た人は、
こんな製品も見ています
-
心筋細胞 MiraCell® Cardiomyocytes (from ChiPSC12) Kit
心毒性解析に
-

Cellartis® DEF-CS™ 500 Culture System
簡便に高未分化維持!iPS細胞のゲノム編集にも最適な培養システム
-
神経分化培地 NDiff® 227
マウスES細胞の神経分化やヒトiPS/ES細胞のGround State維持に
-

Cellartis® MSC Xeno-Free Culture Medium
ヒト間葉系幹細胞のXeno-Free培地
-

Cellartis® Hepatocyte Differentiation Kit
胚体内胚葉(DE)細胞から肝細胞への分化誘導には
-

ヒトKu80細胞核マーカー特異的マウスモノクローナル抗体
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。

