- EGFPと同等の機能性をもつ単量体緑色蛍光タンパク質
- EGFPよりも明るく融合タンパク質タグとして理想的
- EGFP用のフィルターセットと抗体が使用可能
- DsRed-Monomer赤色蛍光タンパク質との蛍光二重標識に最適
製品説明
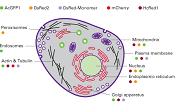
AcGFP1緑色蛍光タンパク質はクラゲの一種Aequorea coerulescensから発見された蛍光タンパク質を改変したもので、すでに利用されている変異型GFPタンパク質(EGFP; 1)に代わる製品である。ORFはヒトのコドン使用のため最適化されており、EGFPタンパク質とはアミノ酸レベルで94%のホモロジーを有する。この最適化により、AcGFP1 mRNAの翻訳効率が上昇し、哺乳類細胞でより高いタンパク質発現につながる。さらに、AcGFP1 タンパク質は安定なため、非常に長時間にわたって蛍光を観察できる。発色基は速やかに飽和レベルに達し、トランスフェクションの8~12時間後から検出できる。また、Clontechの全ての蛍光タンパク質と同様、検出に際し補助因子や酵素基質などを外部から補う必要はない(2~4)。AcGFP1タンパク質は単量体であり、目的とするタンパク質を可視化し追跡するための蛍光タグとして理想的である。これまでに、さまざまな特性を持った数多くのタンパク質や細胞内小器官との融合タンパク質タグとして用いられており、その有用性はすでに確認済みである。DsRedタンパク質と組み合わせて使用し、二種類の目的タンパク質を同時に標識するのに適しており、細胞内小器官や細胞内の特定位置を効率よく可視化することができる(図1)。
細胞内特定タンパク質の追跡実験など細胞を使った他のアッセイにも真価を発揮し(図2)、また、ターゲットとなる細胞はフローサイトメトリーにて容易に検出・ソーティングできる(図3)。
目的タンパク質のN末あるいはC末にAcGFP1を融合して発現するためのベクター(pAcGFP1-C1など)、細菌で使用するほか遺伝子供給源としても利用できるベクター(pAcGFP1)、細胞内局在化を調べるためのベクター(pAcGFP1-Actinなど)をはじめ、プロモーター活性を研究するためのプロモーターレスベクター(pAcGFP1-1)、ウイルス発現系のベクター(pLVX-AcGFP1-C1、pRetroQ-AcGFP1-C1など)などさまざまなベクターを用意している。
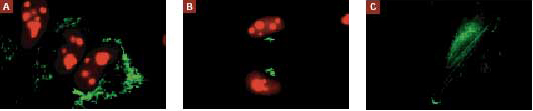
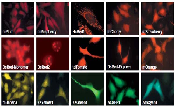
図1. Living Colors AcGFP1は蛍光顕微鏡やその他の多重標識用途に最適
AcGFP1あるいはDsRed2タンパク質と他のタンパク質との融合タンパク質を細胞に一過性トランスフェクション後、蛍光顕微鏡下で観察した。
パネルA:AcGFP1とミトコンドリアのマーカータンパク質との融合タンパク質およびDsRed2と細胞核のマーカータンパク質との融合タンパク質のHEK 293細胞での発現
パネルB:AcGFP1とゴルジ体のマーカータンパク質との融合タンパク質およびDsRed2と細胞核のマーカータンパク質との融合タンパク質のHEK 293細胞での発現
パネルC:AcGFP1とアクチンとの融合タンパク質のHeLa細胞での発現
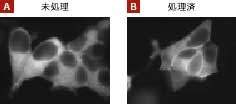
図2. プロテインキナーゼCα(PKCα)の活性化をLiving Colors AcGFP1を用いて追尾可能
パネルA:HEK 293細胞にPKCαとAcGFP1との融合タンパク質をコードしているプラスミドを安定導入した。
パネルB:同細胞をホルボールエステル(PMA)1.5 μg/mlで3分間処理してPKCαの活性化を誘導したところ、PKCαとAcGFP1との融合タンパク質は細胞質から細胞膜へ移動した。この実験結果は、すでに報告されているPKCαの移動パターンと一致している。
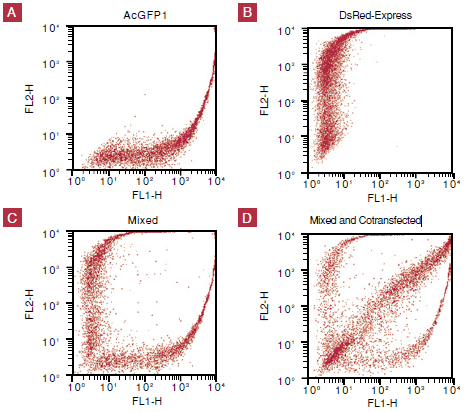
図3. AcGFP1を発現した細胞は標準のFACSで容易に検出可能
HEK 293細胞にコンストラクトをトランスフェクトし、24時間後にフローサイトメトリーで検出した。
パネルA:pAcGFP1のみ、パネルB:pDsRed-Expressのみ
パネルC:細胞にpAcGFP1またはpDsRed-Expressをトランスフェクトし、二つの細胞集団を解析の前に混合した。
パネルD:細胞にpAcGFP1とpDsRed-Expressをコトランスフェクトした。解析前にパネルCの混合物を加えた。コトランスフェクトした集団は対角線に沿って現れている。
真の単量体
AcGFP1タンパク質が単量体として機能することは、以下の三つの独立した実験により確認された。まず、組換え体のAcGFP1タンパク質をFPLCゲル濾過クロマトグラフィー法により分画分析した結果では、分子量にして24 kDaに相当する位置に溶出された(図4、パネルA)。次に、ショ糖密度勾配超遠心法で分画分析したところ、AcGFP1タンパク質の画分パターンは単量体を示し、EGFPのものとほぼ一致した(図4、パネルB)。最後に、組換え体AcGFP1タンパク質のSDS-PAGEによる分析結果を単量体であるEGFPタンパク質および多量体であるDsRed-Expressタンパク質と比較したところ、AcGFP1タンパク質は単量体であることを示す結果となった(図4、パネルC)。以上の結果は、本タンパク質のアミノ酸配列による理論計算値26.9 kDaの分子量とほぼ一致している。
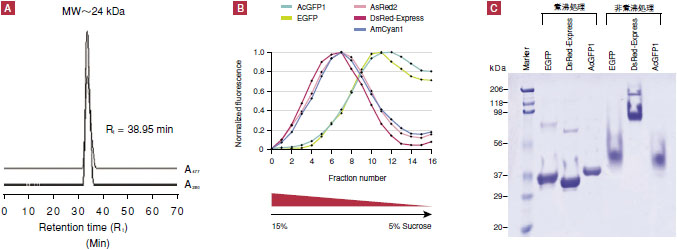
図4. AcGFP1は単量体タンパク質
パネルA:組換え体AcGFP1タンパク質をFPLCゲル濾過クロマトグラフィーで分画解析した。溶出分画について、280 nmにおけるタンパク質の吸光度(A280)と477 nmの励起吸光を同時に連続測定した。AcGFP1タンパク質は、分子量にして24 kDaに相当する位置に溶出された。同タンパク質の分子量の理論計算値は26.9 kDaになる。
パネルB:組換え体AcGFP1タンパク質をショ糖密度勾配(連続)超遠心法で分画解析した。AcGFP1タンパク質画分のパターンはEGFPのものとほぼ一致した。
パネルC:AcGFP1タンパク質のSDS-PAGEによる分析結果である。オリゴマー状態を取るタンパク質の多くは、その試料を4℃で保存し、泳動前に通常行う煮沸処理を行わなければSDS-PAGEの泳動中もその状態をとり続ける。ここでは、煮沸処理(変性条件)、非煮沸処理(非変性条件)それぞれの条件下で組換え体のEGFP、DsRed-Express、AcGFP1タンパク質それぞれ7.5 μgをSDS-PAGE(12%アクリルアミドゲル)で分析した。EGFPとAcGFP1タンパク質は、変性・非変性条件下ともに~30 kDaの位置にシングルバンドとして泳動され、単量体であることが示された。一方、DsRed-Expressタンパク質の場合、非変性条件下では変性条件下と比較して非常に大きな分子量の位置に泳動され、オリゴマー形成が示された。
* SDS-PAGEではやや高分子量側に移動しています。

図4. AcGFP1は単量体タンパク質
パネルA:組換え体AcGFP1タンパク質をFPLCゲル濾過クロマトグラフィーで分画解析した。溶出分画について、280 nmにおけるタンパク質の吸光度(A280)と477 nmの励起吸光を同時に連続測定した。AcGFP1タンパク質は、分子量にして24 kDaに相当する位置に溶出された。同タンパク質の分子量の理論計算値は26.9 kDaになる。
パネルB:組換え体AcGFP1タンパク質をショ糖密度勾配(連続)超遠心法で分画解析した。AcGFP1タンパク質画分のパターンはEGFPのものとほぼ一致した。
パネルC:AcGFP1タンパク質のSDS-PAGEによる分析結果である。オリゴマー状態を取るタンパク質の多くは、その試料を4℃で保存し、泳動前に通常行う煮沸処理を行わなければSDS-PAGEの泳動中もその状態をとり続ける。ここでは、煮沸処理(変性条件)、非煮沸処理(非変性条件)それぞれの条件下で組換え体のEGFP、DsRed-Express、AcGFP1タンパク質それぞれ7.5 μgをSDS-PAGE(12%アクリルアミドゲル)で分析した。EGFPとAcGFP1タンパク質は、変性・非変性条件下ともに~30 kDaの位置にシングルバンドとして泳動され、単量体であることが示された。一方、DsRed-Expressタンパク質の場合、非変性条件下では変性条件下と比較して非常に大きな分子量の位置に泳動され、オリゴマー形成が示された。
* SDS-PAGEではやや高分子量側に移動しています。
EGFP用のフィルターセットと抗体が使用可能
AcGFP1タンパク質のスペクトル特性は、最大励起光波長 475 nm 、最大蛍光波長 505 nmです(表1、図5)。本タンパク質は、EGFPタンパク質と類似のスペクトル特性と蛍光強度を有するため、EGFP やFITC用に使用していたフィルターで検出可能である。また、ChromaTechnology Corporation社などで発売している標準仕様の顕微鏡フィルターセットにも対応できる(表2)。また、Full-Length A.v. PolyclonalやGFPMonoclonal抗体などClontechの豊富なLiving Colors Antibodiesの製品群を使用することで、AcGFP1タンパク質はウェスタンブロットや免疫沈降法でも簡単に検出できる。
表1. Living Colors AcGFP1 タンパク質のスペクトル特性

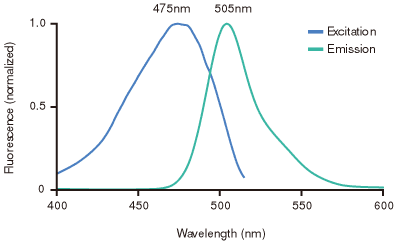
図5. AcGFP1の励起蛍光スペクトル
表2. AcGFP1を検出するフィルターセット
表1. Living Colors AcGFP1 タンパク質のスペクトル特性
| 蛍光 タンパク質 | 励起極大 波長 (nm) | 蛍光極大 波長 (nm) | 検出可能 時間 (時間) | 相対的な 蛍光強度 |
四次構造 | レポーターとしての 有用性 | 融合タンパク質 としての有用性 | モル 吸光係数 (M-1c m-1) | 量子効率 |
| AcGFP1 | 475 | 505 | 8~12 | 明るい | 単量体 | 優れている | 非常に優れている | 32,500 | 0.82 |
| EGFP | 484 | 510 | 8~12 | 明るい | 単量体 | 優れている | 非常に優れている | 23,000 | 0.70 |
| ZsGreen | 493 | 505 | 8~12 | 極めて明るい | 四量体 | 非常に優れている | 使用可能 | 43,000 | 0.91 |

図5. AcGFP1の励起蛍光スペクトル
表2. AcGFP1を検出するフィルターセット
| 種類 | 特徴 |
| EGFP/AcGFP1 Exciter | D425/60x |
| Chroma No. 32000 | Dichroic 470DCXR Emitter D510/40m |
| EGFP/AcGFP1 Preferred Set | Exciter HQ470/40x |
| Chroma No. 41017 | Dichroic Q495LP Emitter HQ525/50m |
保存
-20℃
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。