製品説明
TransIT-mRNAは、培養細胞にRNAをトランスフェクションするための試薬である。RNAを直接細胞質に導入することにより、転写調節機能の影響を受けることなく発現を行うことが可能となる。本製品は、mRNAやウイルスRNAなど、様々なタイプのRNA(2~10 kb)を様々な細胞に効率よく導入することができる。また、細胞毒性が低く血清含有培地で使用できるため、トランスフェクション後の培地交換操作が不要で、操作性にも優れている。12-well plateを使用した場合、1 mlで最大500回、0.4 mlで最大200回使用することができる。
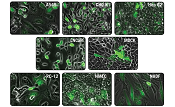
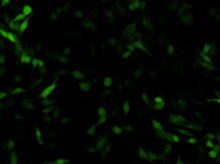
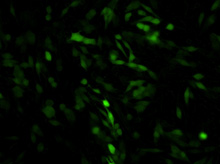
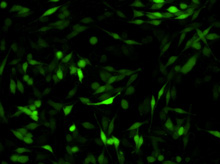
図1. TransIT-mRNAを用いたDC 2.4樹状細胞へのGFP mRNAの導入例
TransIT-mRNAを用いて、キャップ構造とpolyA配列を持ちGFPをコードするmRNAを、DC 2.4細胞に導入した。24-well plateで一晩培養後1×105 cells/wellとなった細胞をトランスフェクションに用い、10時間後にGFPを検出した。
mRNAの添加量:(A)0.5 µg、(B)1 µg、(C)2.5 µg
Data courtesy of Kyle Phua (Principal Investigator: Kam W. Leong), Duke University
 |  |  |
| A | B | C |
|---|
TransIT-mRNAを用いて、キャップ構造とpolyA配列を持ちGFPをコードするmRNAを、DC 2.4細胞に導入した。24-well plateで一晩培養後1×105 cells/wellとなった細胞をトランスフェクションに用い、10時間後にGFPを検出した。
mRNAの添加量:(A)0.5 µg、(B)1 µg、(C)2.5 µg
Data courtesy of Kyle Phua (Principal Investigator: Kam W. Leong), Duke University
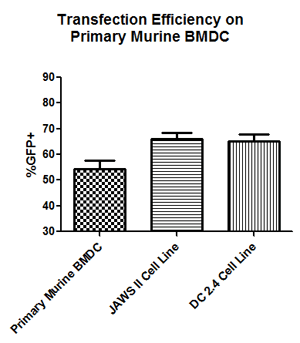
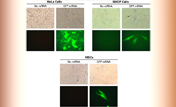
図2. TransIT-mRNAを用いた様々な樹状細胞へのGFP mRNAの導入例
マウス骨髄由来樹状細胞(BMDC)とマウス樹状細胞(JAWSII 及びDC 2.4)に、キャップ構造とpolyA配列を持ちGFPをコードするmRNA 1 μgをTransIT-mRNAを用いて導入した。
試薬:mRNA比TransIT-mRNA Reagent:Boost:mRNA = 1:1:1 (μl:μl:μg)
初代BMDC細胞、JAWSII 細胞及びDC 2.4細胞を24-well plateで一晩培養後、8×105 cells/wellとなったものをトランスフェクションに用いた。トランスフェクションから8時間後にフローサイトメトリーで測定を行った。それぞれ、少なくとも3回の独立した実験を行った。
Data courtesy of Kyle Phua (Principal Investigator: Kam W. Leong), Duke University
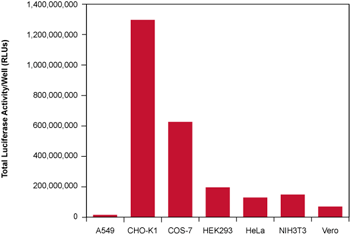
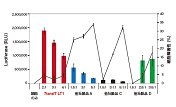
図3. ルシフェラーゼmRNAの導入例
TransIT-mRNAを用いて、12-well plateで培養した各細胞に、キャップ構造とpolyA配列を持ちルシフェラーゼをコードするmRNAを導入した。トランスフェクションから約18時間後に細胞を回収し、ルシフェラーゼ活性を測定した。
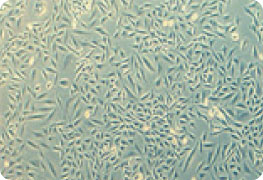 | 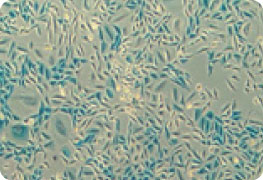 |
| A. Mock Transfection Control | B. LacZ mRNA Transfection |
キャップ構造とpolyA配列を持ちLacZをコードするmRNAをTransIT-mRNAを用いてCHO-K1細胞にトランスフェクションした。トランスフェクションから約18時間後にMirus社のβ-Galactosidase Staining Kitを用いてLacZが導入された細胞を染色した。
(A) トランスフェクションコントロール(mock) (B) LacZ mRNA
iPS細胞作製での使用例
iPS細胞作製のためのmRNAの導入にTransIT-mRNAを使用した例が報告されている。
Highly Efficient Reprogramming to Pluripotency and Directed Differentiation of Human Cells with Synthetic Modified mRNA. Warren et al. 2010. Cell Stem Cell. Volume 7, Issue 5, 618-630.
Innate Immune Suppression Enables Frequent Transfection with RNA Encoding Reprogramming Proteins.
Angel M, Yanik MF. 2010. PLoS One. Jul 23;5(7):e11756.
Highly Efficient Reprogramming to Pluripotency and Directed Differentiation of Human Cells with Synthetic Modified mRNA. Warren et al. 2010. Cell Stem Cell. Volume 7, Issue 5, 618-630.
Innate Immune Suppression Enables Frequent Transfection with RNA Encoding Reprogramming Proteins.
Angel M, Yanik MF. 2010. PLoS One. Jul 23;5(7):e11756.
参考情報
保存
4℃
トランスフェクション試薬選択 オンラインツール
◆選択ガイド
実験目的別に、各標的細胞に最適な遺伝子導入試薬(Mirus社製品)をまとめました。
効率的な試薬の選択にご活用ください。
効率的な試薬の選択にご活用ください。
▶ 遺伝子導入試薬 選択ガイド(Mirus社)
◆検索ツール
| “Reagent Agent”は、Mirus社が提供するトランスフェクション試薬の検索ツールです。 細胞と導入する核酸の種類から、推奨されるトランスフェクション試薬を検索することができます。 |

|
この製品を見た人は、
こんな製品も見ています
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。