アデノ随伴ウイルス(AAV)ベクターはP1レベルの施設で取扱い可能であり、安全で容易に扱えることから、近年、in vivo実験や遺伝子治療などの分野でも注目されています。
安全にAAVベクターを作製できるシステム【 AAVpro Helper Free System 】とAAVベクター産生用のトランスフェクション試薬【 TransIT-VirusGEN Transfection Reagent 】およびAAVベクターの精製キット【 AAVpro Purification Kit Midi (All Serotypes) 】をセットでご使用いただいた評価結果をご紹介します。
安全にAAVベクターを作製できるシステム【 AAVpro Helper Free System 】とAAVベクター産生用のトランスフェクション試薬【 TransIT-VirusGEN Transfection Reagent 】およびAAVベクターの精製キット【 AAVpro Purification Kit Midi (All Serotypes) 】をセットでご使用いただいた評価結果をご紹介します。
◆K大学 K様
Q1.実験の概要を簡単に教えてください。
◆H大学 S様
EF1a NLS-flox(mCherry)-EGFP配列を持つAAV1とCAG iCre配列を持つAAV5を作製した。両者を同時に293T細胞に感染させることで、各ウイルスベクターが機能するかを確認した。
Q2.精製に使用したセロタイプは?AAV1とAAV5
Q3.実験に用いた細胞と遺伝子導入の標的は?実験に用いた細胞(ウイルス産生用細胞):293T細胞
標的細胞:293T細胞
Q4.AAVpro Helper Free System (AAV2)、TransIT-VirusGEN Transfection Reagent、AAVpro Purification Kit Midi (All Serotypes)を用いた評価データや感想を教えてください。標的細胞:293T細胞
【AAVpro Purification Kit Midi (All Serotypes)を用いたデータ】
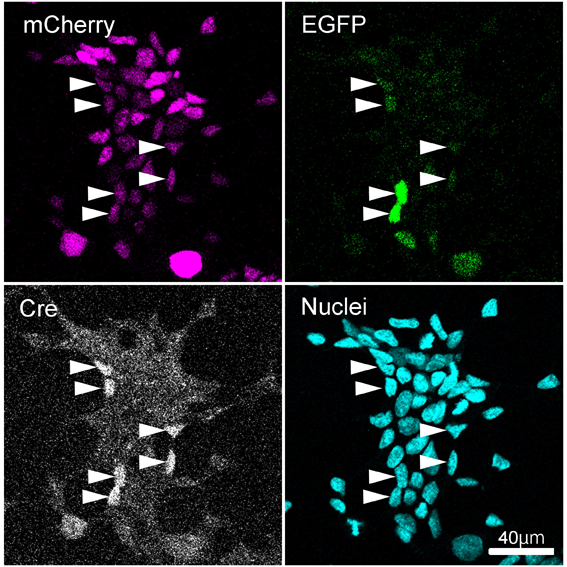
Q1で記したAAV1とAAV5を293T細胞に感染させ、2日後に固定し、rabbit anti- Cre recombinase antibodyを用いて免疫染色をおこなった。全ての細胞でmCherryの発現が認められ、一部の細胞でCre recombinaseの染色が認められた(矢頭)。Cre陽性細胞でEGFPの発現が認められたことから、導入された遺伝子が機能している事が分かった。
【感想】
初めてウイルス実験をおこなったが、超遠心機を用いた分離精製を必要としないため手軽にウイルス精製が出来た。
Q5.使ったことがない人に一言!
Q1で記したAAV1とAAV5を293T細胞に感染させ、2日後に固定し、rabbit anti- Cre recombinase antibodyを用いて免疫染色をおこなった。全ての細胞でmCherryの発現が認められ、一部の細胞でCre recombinaseの染色が認められた(矢頭)。Cre陽性細胞でEGFPの発現が認められたことから、導入された遺伝子が機能している事が分かった。
【感想】
初めてウイルス実験をおこなったが、超遠心機を用いた分離精製を必要としないため手軽にウイルス精製が出来た。
本精製kitを用いることで、シンプルな工程かつ短時間でのウイルス作製が可能でした。AAVを使った実験を始めたい方は、試してみても良いかと思います。
Q1.実験の概要を簡単に教えてください。
期待していたよりもノックダウン効果が低かった点については少し残念であったが、2xU6ベクターを用いたり他のshRNA配列を使用すればより強いノックダウン効果が得られるのかもしれないので今後機会があればトライしてみたい。ウイルス調製キットに関しては非常に簡便で使い勝手が良いと感じたので他の人にも勧めてみたい。
Q5.使ったことがない人に一言!
◆H大学 M様
血管内皮細胞に発現するある遺伝子Xをin vivoでノックダウンする実験を行うことを前提に、まずはin vitroでマウス由来腫瘍血管内皮細胞にshRNA発現AAVが感染し、十分なノックダウン効果が得られるかどうかを検証した。shRNA配列については既にレンチウイルスを用いたノックダウン実験で90%程度のノックダウン効果が認められている配列をIn fusion法によりpAAV-U6-ZsGreen1ベクターに挿入した。
Q2.精製に使用したセロタイプは?AAV1
Q3.実験に用いた細胞と遺伝子導入の標的は?実験に用いた細胞:マウス由来の腫瘍血管内皮細胞(当研究室で単離したもの)
標的遺伝子:腫瘍血管内皮細胞に発現する遺伝子X
Q4.AAVpro Helper Free System (AAV2)、TransIT-VirusGEN Transfection Reagent、AAVpro Purification Kit Midi (All Serotypes)を用いた評価データや感想を教えてください。標的遺伝子:腫瘍血管内皮細胞に発現する遺伝子X
- ZsGreenのシグナル強度をFlow cytometerで測定し、血管内皮細胞へのAAVの感染効率を評価した。データシート通り10 cm dish 1枚から回収したAAVを×1~×625の希釈濃度(50 μl/well)で血管内皮細胞(2.5×104 cells/well, 6 well plate)に感染させた。
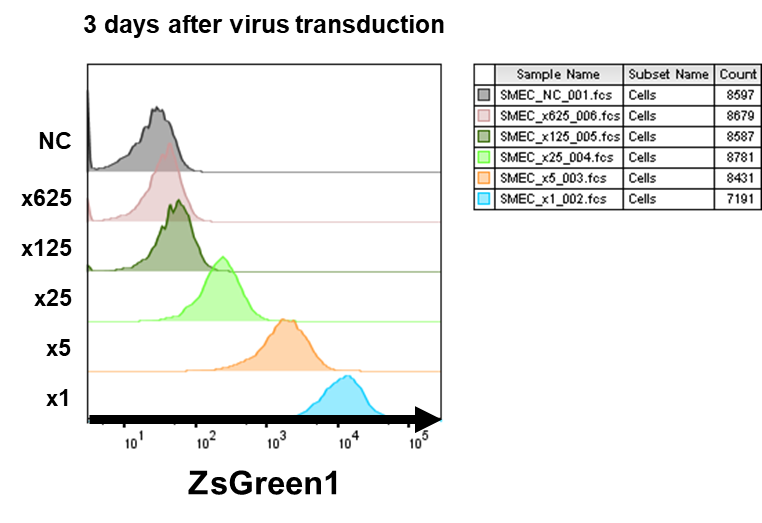
希釈倍率に応じてZsGreenのシグナル強度が低下することが確認され、×1や×5では100%の導入効率であった。 - shRNA発現AAVを作成し、同様に感染実験を行った。AAV感染3日後のノックダウン効率をqPCRで評価したところ、約50%のノックダウン効果が認められた。
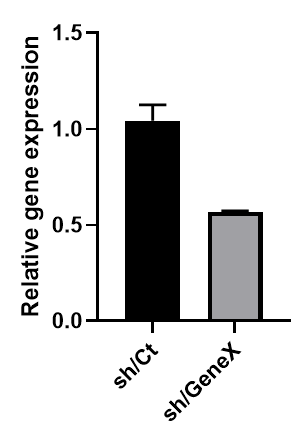
期待していたよりもノックダウン効果が低かった点については少し残念であったが、2xU6ベクターを用いたり他のshRNA配列を使用すればより強いノックダウン効果が得られるのかもしれないので今後機会があればトライしてみたい。ウイルス調製キットに関しては非常に簡便で使い勝手が良いと感じたので他の人にも勧めてみたい。
簡便に作成できるので、遺伝子導入実験に使用するベクターの1つの候補として検討する価値があるのではないかと思います。
Q1.実験の概要を簡単に教えてください。
Q5.使ったことがない人に一言!
◆K大学 H様
ヒト神経芽細胞腫SH-SY5Y細胞におけるLAMP1タンパク質過剰発現
Q2.精製に使用したセロタイプは?AAV2
Q3.実験に用いた細胞と遺伝子導入の標的は?実験に用いた細胞:ヒト神経芽細胞腫SH-SY5Y細胞
標的遺伝子:LAMP1 (human)
Q4.AAVpro Helper Free System (AAV2)、TransIT-VirusGEN Transfection Reagent、AAVpro Purification Kit Midi (All Serotypes)を用いた評価データや感想を教えてください。標的遺伝子:LAMP1 (human)
| 1回目 (濃縮なし) | 2回目 (100 mm dish 2枚から濃縮) | 3回目 (100 mm dish 4枚から濃縮) | |
|---|---|---|---|
| 空ベクター | 2.5×1010 copies/ml | 4.1×1010 copies/ml | 1.9×109 copies/ml |
| LAMP1 | 4.3×1010 copies/ml | 3.9×109 copies/ml | 4.7×108 copies/ml |
SH-SY5Y細胞への遺伝子導入にはお勧めしない。
(論文で報告されているMOI(100,000程度)で実験を行うことが困難)
(論文で報告されているMOI(100,000程度)で実験を行うことが困難)
Q1.実験の概要を簡単に教えてください。
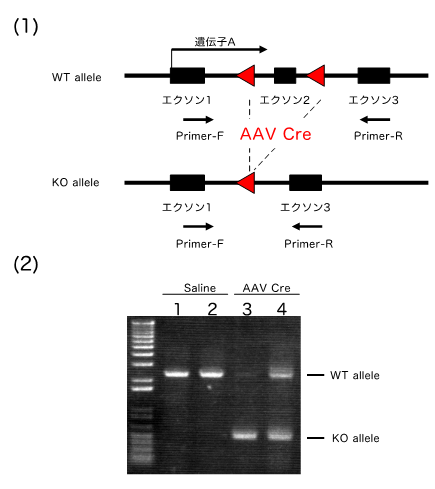
遺伝子Aの脳における機能を明らかにするため、遺伝子Aのエクソン2をloxPで挟んだfloxマウスを作製した。そのうえで、3週齢のfloxマウスの眼窩静脈叢よりAAV Creリコンビナーゼを静注し、その3週間後に、脳内における遺伝子発現等の機能解析を行った。
Q2.精製に使用したセロタイプは?AAV2
Q3.実験に用いた細胞と遺伝子導入の標的は?実験に用いた細胞:3週齢のマウス
標的遺伝子:目的遺伝子A
Q4.AAVpro Helper Free System (AAV2)、TransIT-VirusGEN Transfection Reagent、AAVpro Purification Kit Midi (All Serotypes)を用いた評価データや感想を教えてください。
標的遺伝子:目的遺伝子A
【結果】
【感想】
AAV Extraction Solution AおよびBを利用することで超遠心機を用いることなく簡便に、AAVの調製ができ大変手間が省けてよかった。また、pAAV-CMV Vector があるので、今後、様々な遺伝子のAAV作製に利用できるなど非常に汎用性に富んだキットだと思った。
Q5.使ったことがない人に一言!
今回、遺伝子Aのfloxマウスに対し、AAVpro Helper Free System (AAV2)を用いて作製したAAV Creの感染実験を行った。3週齢のfloxマウスの眼窩静脈叢よりAAV Creリコンビナーゼを静注し、その3週間後に、大脳皮質を採取しDNA抽出後PCRにて、loxP組み換えを確認した。その結果、図に示すように、個体差(3及び4)はあるものの、効率的に作製したAAV Creが機能していることが確認された。生じた個体差は、AAV Creそのものに起因するものでなく、マウスの眼窩静脈叢への静注における実験誤差によるものと思われる。

【感想】
AAV Extraction Solution AおよびBを利用することで超遠心機を用いることなく簡便に、AAVの調製ができ大変手間が省けてよかった。また、pAAV-CMV Vector があるので、今後、様々な遺伝子のAAV作製に利用できるなど非常に汎用性に富んだキットだと思った。
今後、遺伝子治療への応用を目指したAAVが盛んになると考えられるが、本キットはその手始めとしてこれまでに、AAV作製を行ったことのない者に対しても非常に簡便に効果的なAAV作製を行うことができる。
※個人の感想であり、製品の性能を確約するものではありません。
この製品を見た人は、
こんな製品も見ています
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。