多孔性スポンジを用いて、レンチウイルスによる遺伝子導入が簡便に
- 24ウェルサイズの多孔性スポンジを用いて、迅速、効率的にレンチウイルスによる遺伝子導入が可能
- 1つのスポンジで1×105~107個の幅広い細胞数で処理が可能
- 遠心感染や、ポリブレンなどの導入促進剤は不要。細胞へのダメージを低減
- 細胞株、初代細胞など、様々な細胞に同一の簡便な手順で使用可能
無料サンプルご提供中!
サンプルのお申し込みはこちらから
サンプルのお申し込みはこちらから
製品説明
Lenti-X Transduction Spongeは多孔性のアルギン酸塩で構成されたスポンジ状の製品で、簡便にレンチウイルスによる遺伝子導入が可能です。スポンジの微細な流路構造の中で細胞とレンチウイルスが局在することにより、時間を要する遠心感染法や細胞への影響が懸念される化学的な導入促進剤を用いることなく、迅速、かつ効率的に細胞への遺伝子導入が促進されます。24ウェルプレートサイズのため少ない液量で利用でき、1つのスポンジで1×105~107個の細胞が使用できます。特別な機器は必要なく、細胞株(接着細胞、浮遊細胞)、形質導入が難しい初代細胞など、様々な細胞への遺伝子導入を同じ簡便な手順で行うことが可能で、従来法と同等以上の導入効率が得られます。
簡便な使用方法
まず、ターゲット細胞とレンチウイルスを混合してスポンジに添加し、37℃で1時間インキュベートしてスポンジに混合液を吸収させます。次に、培地を加えて16~24時間インキュベートします。翌日、特殊なRelease Bufferを加えてスポンジを溶解し、細胞を回収します。

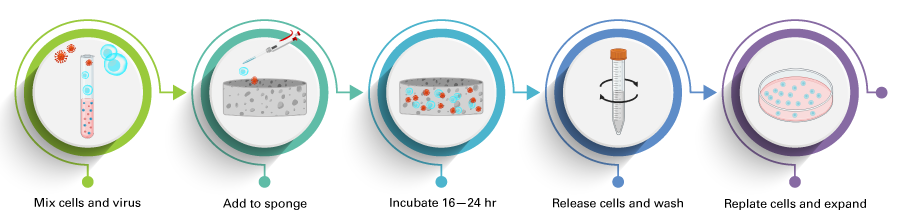 図1.Lenti-X Transduction Spongeのワークフロー
図1.Lenti-X Transduction Spongeのワークフロー

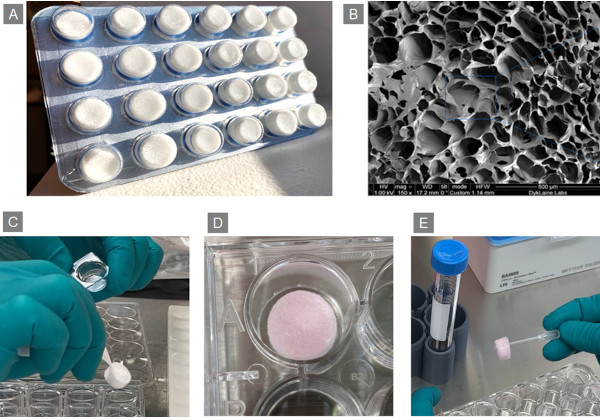 図2.Lenti-X Transduction Spongeの外観と使用イメージ
図2.Lenti-X Transduction Spongeの外観と使用イメージ
Panel A:製品外観、24個のスポンジが個別にパックされている
Panel B:製品拡大写真(×150)、20~300 μm の微細な流路構造
Panel C:ピンセットでスポンジを取り出し24ウェルプレートにセット
Panel D:細胞とウイルス液をスポンジに添加し1時間インキュベート
Panel E:培地を添加して16~24時間後に培養液とスポンジを15 mlチューブに移す
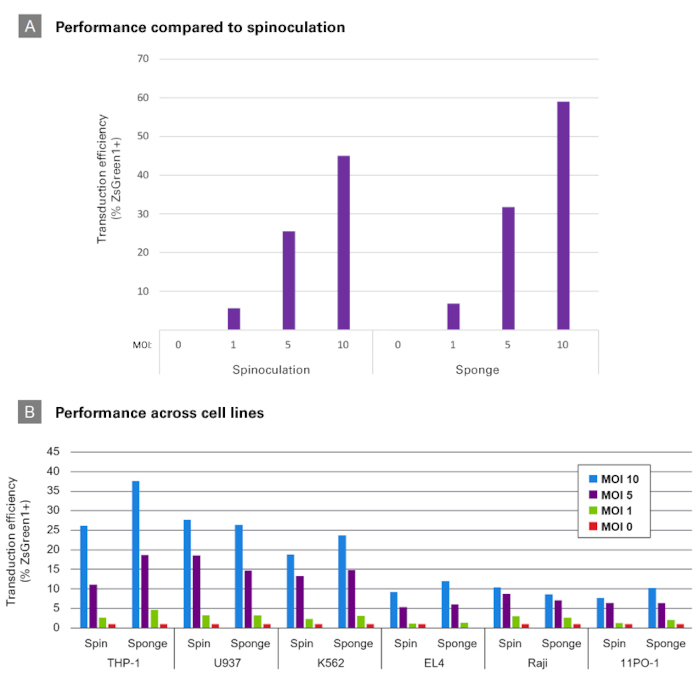
図3.Lenti-X Transduction Spongeと遠心感染法(Spinoculation)の比較

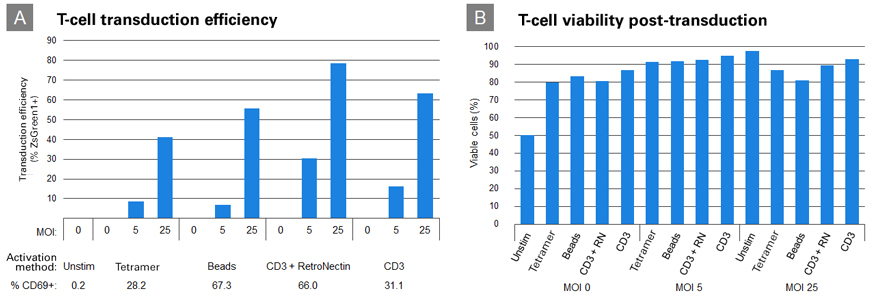 図4.Lenti-X Transduction Spongeを用いた初代T細胞への遺伝子導入
図4.Lenti-X Transduction Spongeを用いた初代T細胞への遺伝子導入

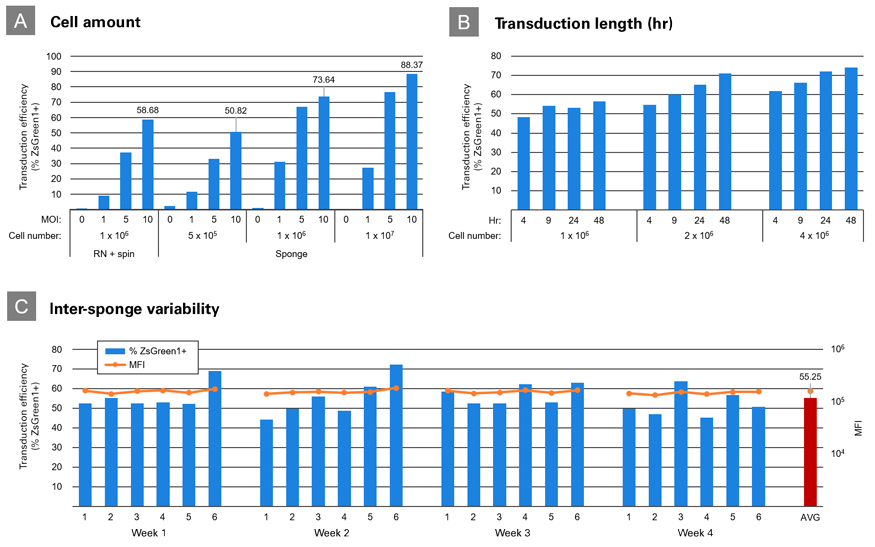 図5.Lenti-X Transduction Spongeの一貫性の検証
図5.Lenti-X Transduction Spongeの一貫性の検証

- ターゲット細胞とレンチウイルスを混合する(トータル液量の上限は150 μl)
- スポンジを24ウェルプレートにセットし、細胞とウイルスの混合液を滴下する
- 37℃のCO2インキュベーター内で1時間静置後、培地を添加して16~24時間インキュベーター内で培養する
- 翌日、培地とスポンジを15 mlチューブに移し、Release Bufferを添加、遠心してスポンジを溶解し、リリースされた細胞をPBSで2回Washする
- 細胞を新しい培養容器に移して培養を開始する

Panel A:製品外観、24個のスポンジが個別にパックされている
Panel B:製品拡大写真(×150)、20~300 μm の微細な流路構造
Panel C:ピンセットでスポンジを取り出し24ウェルプレートにセット
Panel D:細胞とウイルス液をスポンジに添加し1時間インキュベート
Panel E:培地を添加して16~24時間後に培養液とスポンジを15 mlチューブに移す

図3.Lenti-X Transduction Spongeと遠心感染法(Spinoculation)の比較
Panel A:1×106個のJurkat細胞に、遠心感染法またはLenti-X Transduction Spongeを使用して、MOI=1、5、10で ZsGreen1発現レンチウイルスによる遺伝子導入(トランスダクション)を実施した。遠心感染法は、8 μg/mlポリブレンの存在下で、32℃、1,400×g 、90分間遠心した。トランスダクションから48時間後にFCM解析によってZsGreen1の発現効率を調べた。
Panel B: Panel Aと同じ方法でさまざまな細胞株に対してZsGreen1発現レンチウイルスによるトランスダクションを実施し、発現効率を調べた。
いずれの細胞でも、Lenti-X Transduction Spongeで遠心感染法と同等以上の効率が得られた。
いずれの細胞でも、Lenti-X Transduction Spongeで遠心感染法と同等以上の効率が得られた。

Panel A:ヒト初代T細胞を、MHC テトラマー、抗CD3/CD28抗体ビーズ、CD3+RetroNection、CD3のみの条件でそれぞれ活性化し、48時間後にCD69+の発現率を測定して活性化レベルを調べた。次に、Lenti-X Transduction Spongeを用いて1×106個の活性化細胞にZsGreen1発現レンチウイルスをMOI=5、25で24時間トランスダクションした。トランスダクションから48時間後にFCM解析によってZsGreen1の発現効率を調べた。
Panel B:7-AAD染色、FCM解析によってトランスダクションから48時間後の細胞の生存率を調べた。
上記の結果、Lenti-X Transduction Spongeの初代T細胞へのトランスダクション促進効果と高い細胞生存率が確認された。
上記の結果、Lenti-X Transduction Spongeの初代T細胞へのトランスダクション促進効果と高い細胞生存率が確認された。

Panel A: RetroNectin+遠心感染(RN+Spin)、またはLenti-X Transduction Sponge(Sponge)を用いてZsGreen1発現レンチウイルス(MOI=0、1、5、10)をJurkat細胞に24時間トランスダクションし、発現効率を比較した。(使用した細胞数:RN+Spin;1×106、Sponge;5×105、1×106、1×107)
Panel B:Lenti-X Transduction Spongeを用いてZsGreen1発現レンチウイルス (MOI=10) をJurkat細胞に4、9、24、48時間トランスダクションし、トランスダクション時間の影響を調べた。(使用した細胞数:1×106、2×106、4×106)
Panel C:Lenti-X Transduction Spongeを用いて、ZsGreen1発現レンチウイルス(MOI=2.5)を1×106個のJurkat細胞に、週6回、4週間にわたってトランスダクションを実施し、スポンジ間の変動を検証した(%CV=12.6)。トランスダクションから48時間後にFACS解析によってZsGreen1陽性細胞の割合と平均蛍光強度(MFI)を調べた。赤色(AVG)は全試験における ZsGreen1の平均発現率である。
上記の結果、Lenti-X Transduction Spongeは、スポンジ間のバラつきが少なく、使用する細胞数やトランスダクション時間を変化させても一貫して高い導入効率を得られることが示された。内容
- Lenti-X Transduction Sponges 24個
- Release Buffer 30 ml
- ピンセット 1個
保存
4℃
(Lenti-X Transduction Spongesは乾燥剤入りのパウチに入れたまま保存)
(Lenti-X Transduction Spongesは乾燥剤入りのパウチに入れたまま保存)
本製品以外に必要な試薬、機器(主なもの)
- 1×PBS containing Ca2+ and Mg2+
- 24ウェルプレート(ノントリートメントタイプ)
- 15 mlチューブ
- 遠心機(15 mlチューブ対応)
- インキュベーター
- 注意事項
- 本ページの製品はすべて研究用として販売しております。ヒト、動物への医療、臨床診断用には使用しないようご注意ください。また、食品、化粧品、家庭用品等として使用しないでください。
- タカラバイオの承認を得ずに製品の再販・譲渡、再販・譲渡のための改変、商用製品の製造に使用することは禁止されています。
- タカラバイオ製品に関連するライセンス・パテントについては、ライセンスマークをクリックして内容をご確認ください。
また、他メーカーの製品に関するライセンス・パテントについては、各メーカーのウェブサイトまたはメーカー発行のカタログ等でご確認ください。 - ウェブサイトに掲載している会社名および商品名などは、各社の商号、または登録済みもしくは未登録の商標であり、これらは各所有者に帰属します。